高分辨率空間轉(zhuǎn)錄組技術(shù)揭示胰腺癌轉(zhuǎn)移過程中的譜系塑性

在癌癥治療領(lǐng)域,胰腺導(dǎo)管腺癌(PDAC)因其高度侵襲性與轉(zhuǎn)移性,長期被視為“最難攻克的堡壘”之一。腫瘤組織內(nèi)部及不同轉(zhuǎn)移部位之間存在的空間異質(zhì)性,是導(dǎo)致治療抵抗和預(yù)后不良的重要原因。然而,傳統(tǒng)研究手段難以系統(tǒng)性、精細(xì)化地描繪這一異質(zhì)性。
近日,發(fā)表在《Nature》的重磅研究《Spatial mapping of transcriptomic plasticity in metastatic pancreatic cancer》,通過應(yīng)用高分辨率空間轉(zhuǎn)錄組技術(shù),系統(tǒng)繪制了轉(zhuǎn)移性胰腺癌的空間轉(zhuǎn)錄組圖譜。該研究為理解腫瘤轉(zhuǎn)移過程中的細(xì)胞譜系演變、克隆動態(tài)變化及微環(huán)境重塑提供了洞察。
文章研究亮點
1.技術(shù)平臺與樣本
本研究基于13位轉(zhuǎn)移性胰腺導(dǎo)管腺癌(PDAC)患者,共收集49份原發(fā)灶及多器官轉(zhuǎn)移灶(肝、肺、腹膜)的冷凍組織樣本,為確保RNA質(zhì)量與空間結(jié)構(gòu)保存,全部樣本經(jīng)快速自體解剖獲得。
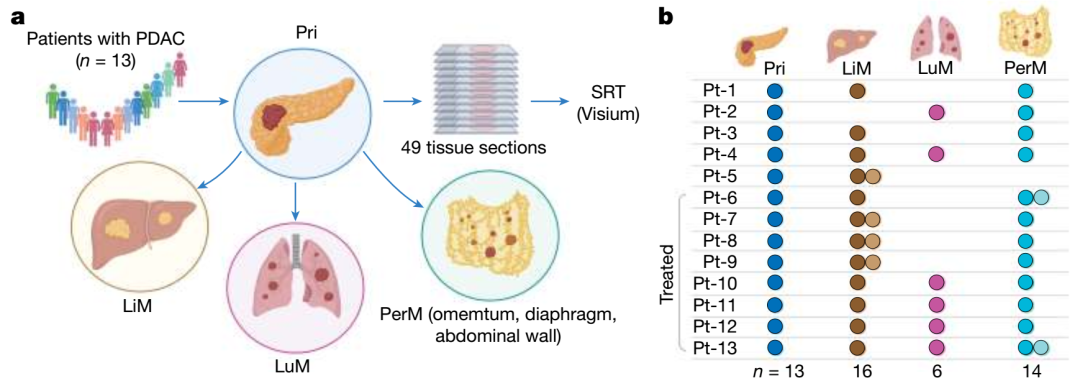
研究采用10x Genomics Visium平臺進(jìn)行高通量空間轉(zhuǎn)錄組測序,實現(xiàn)了在組織結(jié)構(gòu)背景下對超過13萬空間點的轉(zhuǎn)錄組水平數(shù)據(jù)采集與分析。同時,輔以CosMx Spatial Molecular Imaging (SMI)平臺,搭配1,000-plex RNA panel,開展單細(xì)胞分辨率的空間多重RNA成像,針對關(guān)鍵細(xì)胞類型與信號通路(如TGFB1、CXCL12–CXCR4)進(jìn)行獨立驗證與空間互作細(xì)節(jié)解析。
通過Visium平臺的廣覆蓋能力與CosMx技術(shù)的超高分辨率互補結(jié)合,本研究得以系統(tǒng)揭示轉(zhuǎn)移性PDAC內(nèi)部的譜系演化、克隆異質(zhì)性及腫瘤微環(huán)境重塑特征,為后續(xù)空間生物學(xué)分析提供堅實的數(shù)據(jù)基礎(chǔ)。
2.多樣化克隆演化模式
通過推斷空間拷貝數(shù)變異(CNV)構(gòu)建的系統(tǒng)發(fā)育樹,揭示了患者間高度異質(zhì)的轉(zhuǎn)移模式,包括原發(fā)灶內(nèi)部多克隆分化、器官特異性克隆適應(yīng)等現(xiàn)象,為進(jìn)一步理解治療耐藥提供了新視角。
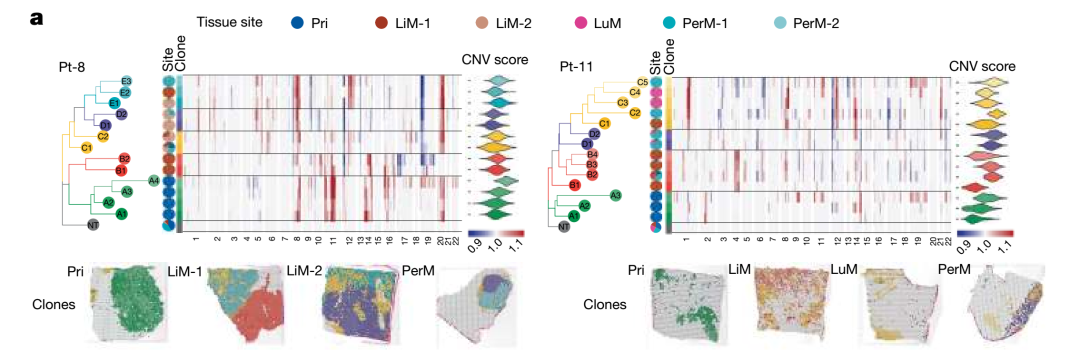 系統(tǒng)進(jìn)化克隆樹揭示PDAC中多樣化的進(jìn)化模式
系統(tǒng)進(jìn)化克隆樹揭示PDAC中多樣化的進(jìn)化模式
3.揭示轉(zhuǎn)移過程中的譜系塑性
研究發(fā)現(xiàn),癌細(xì)胞在從原發(fā)灶向肝臟、肺部和腹膜轉(zhuǎn)移過程中,發(fā)生了顯著的譜系狀態(tài)切換。例如,肝轉(zhuǎn)移灶中以侵襲性較強的basal-like譜系為主,而肺轉(zhuǎn)移灶則富集較為分化的classical譜系細(xì)胞。
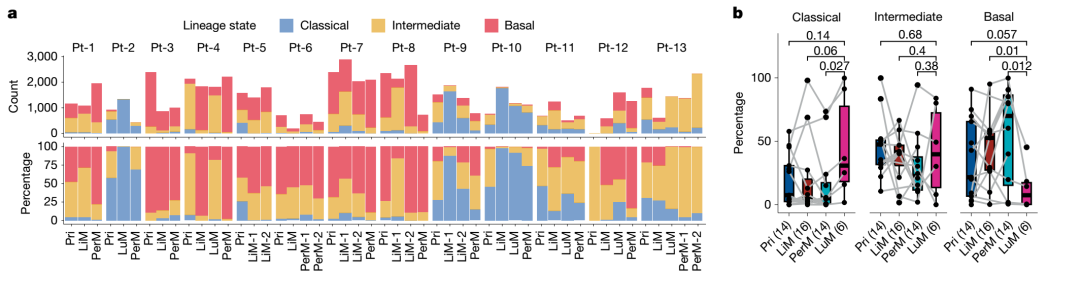 腫瘤譜系狀態(tài)在原發(fā)及轉(zhuǎn)移灶中的空間重塑
腫瘤譜系狀態(tài)在原發(fā)及轉(zhuǎn)移灶中的空間重塑
4.空間結(jié)構(gòu)與免疫微環(huán)境重塑
研究發(fā)現(xiàn),在轉(zhuǎn)移性胰腺癌組織中,basal-like腫瘤細(xì)胞群周圍高度富集表達(dá)TGFB1的肌成纖維樣癌相關(guān)成纖維細(xì)胞(myCAFs),與腫瘤細(xì)胞形成致密包裹,并伴隨明顯的漿細(xì)胞排斥現(xiàn)象。進(jìn)一步應(yīng)用CosMx SMI平臺進(jìn)行單細(xì)胞分辨率空間驗證,確認(rèn)了myCAFs與腫瘤細(xì)胞的鄰近分布,以及CXCL12在myCAFs中、CXCR4在漿細(xì)胞中的表達(dá)模式。空間鄰域分析顯示,漿細(xì)胞在腫瘤細(xì)胞鄰近區(qū)域顯著減少,支持空間排斥現(xiàn)象,提示CXCL12–CXCR4軸可能在局部免疫抑制中發(fā)揮關(guān)鍵作用。
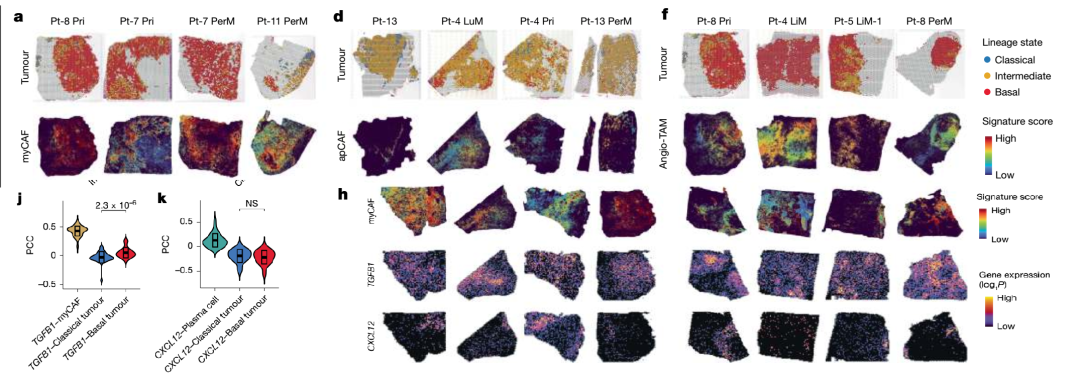 PDAC腫瘤點在基礎(chǔ)譜系中的共同定位和myCAF的標(biāo)志性評分
PDAC腫瘤點在基礎(chǔ)譜系中的共同定位和myCAF的標(biāo)志性評分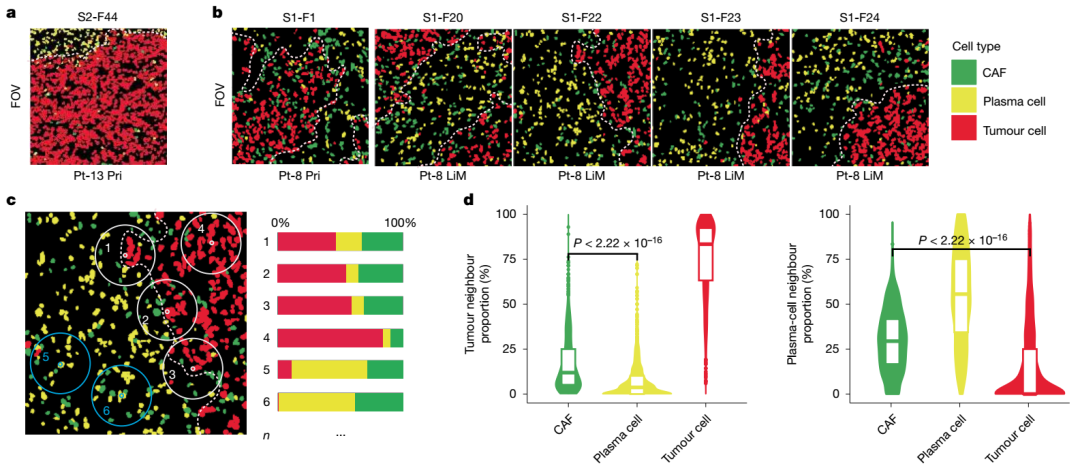 CosMx SMI揭示myCAFs與漿細(xì)胞的空間排斥分布
CosMx SMI揭示myCAFs與漿細(xì)胞的空間排斥分布空間轉(zhuǎn)錄組技術(shù)的關(guān)鍵價值
本研究充分展現(xiàn)了空間轉(zhuǎn)錄組技術(shù)在癌癥研究中的核心優(yōu)勢,主要體現(xiàn)在以下四個方面:
1、空間定位與高通量表達(dá)檢測同步實現(xiàn)
保留組織原位結(jié)構(gòu),避免傳統(tǒng)單細(xì)胞測序因解離導(dǎo)致的空間信息丟失。實現(xiàn)數(shù)萬空間點位的轉(zhuǎn)錄組層面數(shù)據(jù)采集,兼顧高分辨率與廣覆蓋。
2、細(xì)胞間互作與微環(huán)境重塑的深入解析
精準(zhǔn)揭示腫瘤細(xì)胞、成纖維細(xì)胞、免疫細(xì)胞等不同類型細(xì)胞的空間鄰近關(guān)系。解析關(guān)鍵信號軸(如TGFB1、CXCL12–CXCR4)在腫瘤免疫逃逸與微環(huán)境塑形中的作用。
3、腫瘤譜系演化與克隆異質(zhì)性重建
結(jié)合空間拷貝數(shù)變異推斷,繪制腫瘤從原發(fā)灶至多器官轉(zhuǎn)移灶的克隆進(jìn)化軌跡。揭示個體間、不同轉(zhuǎn)移器官間乃至同器官不同病灶之間的克隆演化多樣性D。
4、推動精準(zhǔn)干預(yù)策略與新靶點發(fā)現(xiàn)
在空間信息指導(dǎo)下,可識別具有治療意義的特定細(xì)胞群體及其微環(huán)境依賴特征。為腫瘤免疫治療、抗纖維化干預(yù)及聯(lián)合療法開發(fā)提供新的空間生物學(xué)依據(jù)。
隨著測序平臺不斷升級與空間解析算法的持續(xù)優(yōu)化,空間轉(zhuǎn)錄組學(xué)正逐步在腫瘤學(xué)、發(fā)育生物學(xué)、再生醫(yī)學(xué)、神經(jīng)科學(xué)等多個領(lǐng)域展現(xiàn)出突破性應(yīng)用潛力,成為解碼復(fù)雜組織微環(huán)境不可或缺的研究工具。
- DNA/RNA聯(lián)檢在生物醫(yī)藥領(lǐng)域生物制品中支原體檢測方向的分析
- 高分辨率空間轉(zhuǎn)錄組技術(shù)揭示胰腺癌轉(zhuǎn)移過程中的譜系塑性
- 免疫與癌癥治療的關(guān)鍵靶點CXCR4的結(jié)構(gòu)功能及相關(guān)實驗介紹
- 疾病治療的新興靶點EP4受體結(jié)構(gòu)與功能介紹及相關(guān)藥物研發(fā)的應(yīng)用
- 支原體PCR檢測技術(shù):高效精準(zhǔn)的污染防控解決方案
- 細(xì)胞STR鑒定[Frequently Asked Questions(常見問題解答)]
- 單細(xì)胞轉(zhuǎn)錄組+PDX模型揭示膠質(zhì)母細(xì)胞瘤復(fù)發(fā)機制
- 芯空一號實現(xiàn)的單細(xì)胞空間轉(zhuǎn)錄組檢測數(shù)據(jù)





