線粒體自噬途徑的相關機制和常見檢測方法
■ 什么時候發生線粒體自噬?
線粒體自噬 (Mitochondrial autophagy, mitophagy) 作為一種重要線粒體質量控制機制,在活性氧 (ROS) 脅迫等應激作用下,會導致線粒體 DNA (Mitochondrial DNA, mtDNA) 突變逐漸累積,還會使細胞內線粒體膜電位降低和去極化損傷,并最終導致細胞死亡[1][2]。嚴峻的生存形勢下,線粒體只好 “大開殺戒”,為了維持線粒體和細胞穩態,防止受損線粒體損傷細胞,細胞通過選擇性地包裹和降解細胞內受損或功能障礙的線粒體--即線粒體自噬。
既然被吃已然是定局,那么受損線粒體是如何被 “干掉” 的?這一過程與巨自噬有著很大的相似性,但它更像是細胞器的選擇性自噬去除。
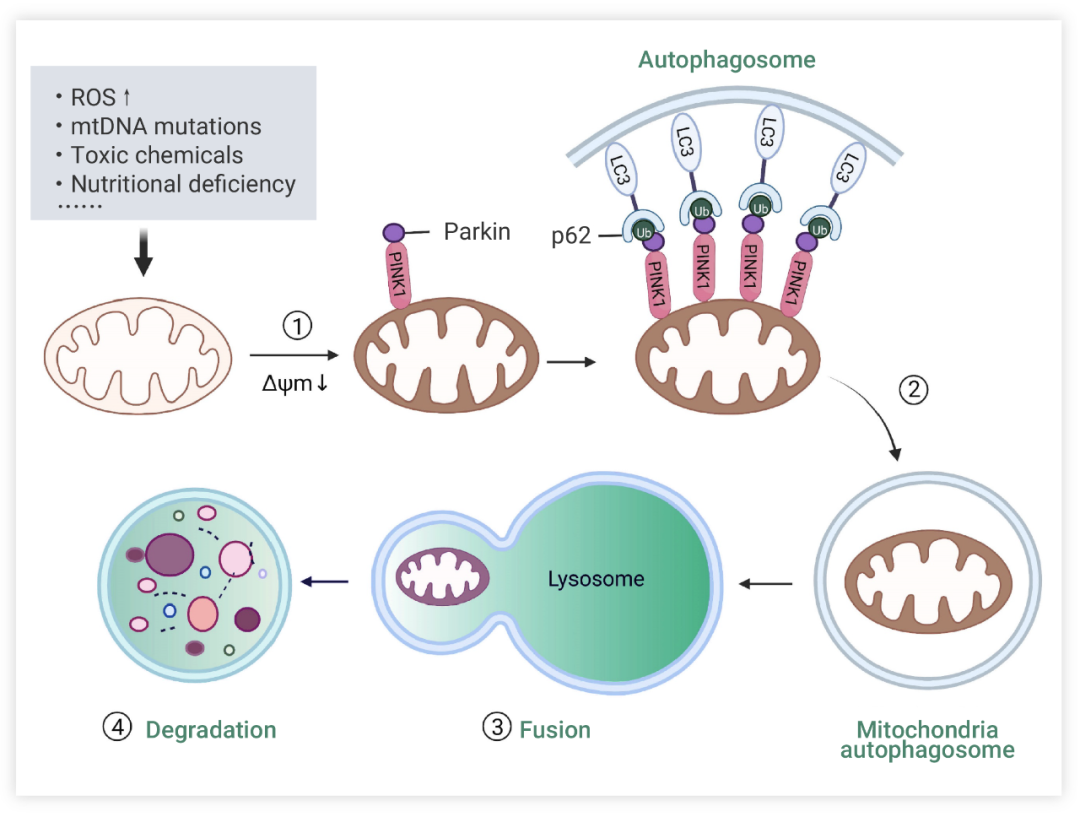
線粒體自噬主要有以下 4 個關鍵步驟:1) 受損線粒體去極化,失去膜電位。2) 線粒體被自噬體包裹形成線粒體自噬體。3) 線粒體自噬體與溶酶體融合。4) 線粒體內容物被溶酶體降解。溶酶體或液泡酸性水解酶流入自噬體降解受損線粒體。
線粒體自噬途徑的相關機制
線粒體自噬的機制通常分為兩類: 泛素依賴途徑和非泛素依賴途徑。
■ 泛素依賴性途徑
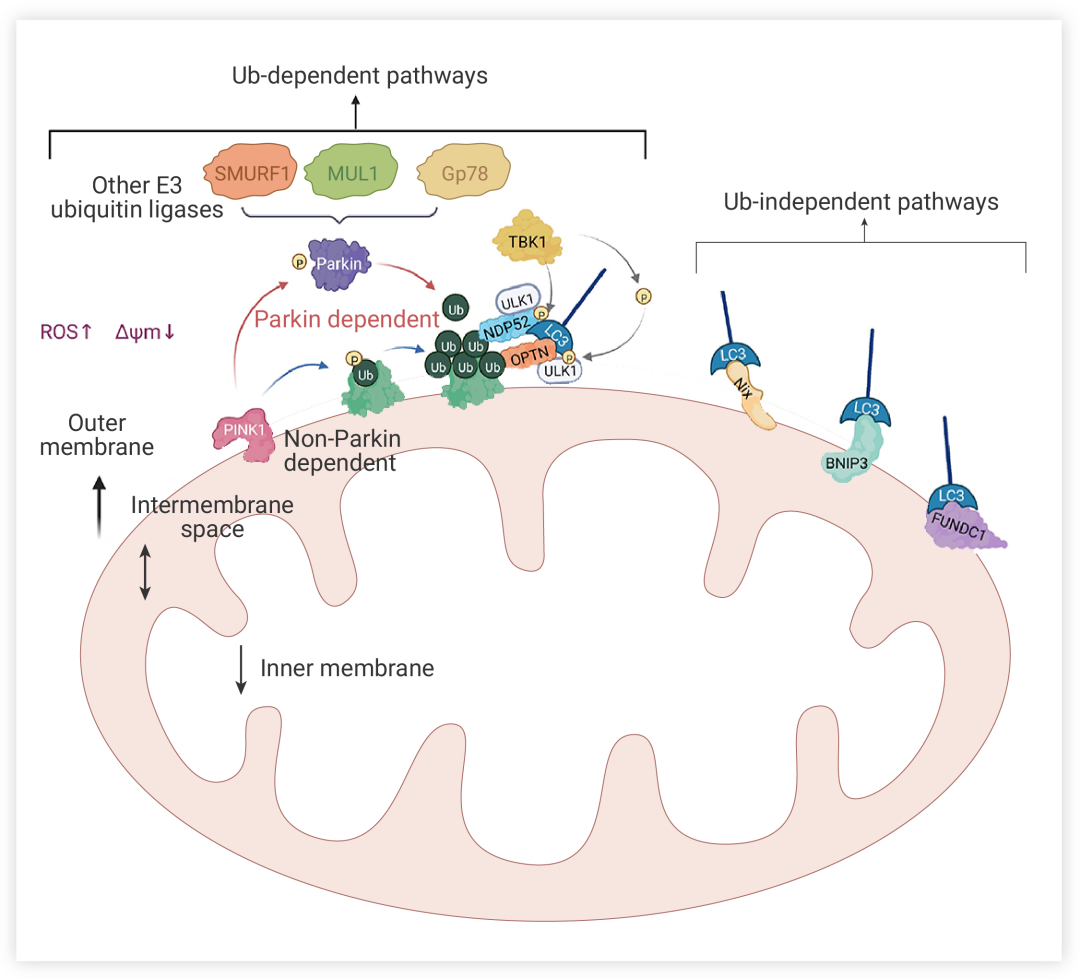
花開兩朵,各表一枝。首先,我們來看一看泛素依賴性途徑,顧名思義,依賴于線粒體表面蛋白的廣泛泛素化來促進線粒體自噬。目前研究最廣泛的便是 PINK1/Parkin 通路。在這一機制中,PTEN 誘導的激酶 1 (PTEN induced kinase 1, PINK1) 堪稱線粒體自噬的得力助手。當線粒體膜電位 (Mitochondrial membrane potential, MMP, ΔΨm) 受損時,PINK1 進入線粒體內膜的途徑受阻,導致 PINK1 在線粒體外膜的胞質面上穩定聚集。同時,這會募集并激活 Parkin,Parkin 蛋白酶的空間構象發生改變,轉化為活化的 E3 泛素連接酶,然后泛素化線粒體上的蛋白質[3]。PINK1 與 Parkin 相互作用,共同調控線粒體自噬過程以維持線粒體質量 (圖 2)。此外,除了 PINK1-Parkin 通路之外,還有非 Parkin 依賴性的泛素依賴性通路。也就是說,PINK1 還可以通過泛素磷酸化直接招募自噬受體蛋白 (如 NIX、BNIP3 和 FUNDC1) 到線粒體,受體蛋白募集 LC3,這使得自噬體能夠吞噬線粒體。
圖 2. 線粒體自噬機制概述[1]
線粒體自噬的 Ub 依賴途徑 (PINK1/Parkin 通路最為常見) 和 Ub 非依賴性途徑
■ 非泛素依賴性途徑
盡管據了解 PINK1 和 Parkin 的激活可以觸發線粒體自噬,但線粒體自噬也可能通過其他機制進行:相比之下,非泛素依賴途徑就略顯 “清閑”,線粒體外膜 (OMM)
上有許多包含 LC3 相互作用區 (LIR) 區域的蛋白,它們是自噬的受體。它們可以不經泛素化直接與 LC3 結合,從而啟動線粒體自噬(圖 2)。在哺乳動物中,這些受體主要包括 Nip3 樣蛋白 X (Nip3-like protein X, NIX) 受體、bcl2 相互作用蛋白 3 (BCL2-interacting protein 3, BNIP3) 受體、FUN14 結構域包含 1 (FUN14 domain containing 1, FUNDC1) 受體
■ 線粒體自噬的相關疾病
正常的線粒體活動對細胞功能至關重要,及時的消除受損線粒體是細胞的自我保護機制。當線粒體自噬發生障礙可觸發多種疾病,如:線粒體功能障礙是阿爾茨海默氏癥,帕金森氏癥,亨廷頓氏癥等神經退行性疾病的關鍵共同因素,PINK1 和 Parkin 的功能缺失突變與家族性帕金森病相關。心肌細胞的活動高度依賴于線粒體的能量供應,線粒體吞噬功能障礙可引起心肌肥厚、心律失常、心源性猝死等心血管疾病[6]。
線粒體自噬,該如何檢測?
線粒體自噬是一個復雜的、動態的過程,檢測方法也在不斷的更新,小 M 以文獻為例,盤點常見的線粒體自噬研究方法!
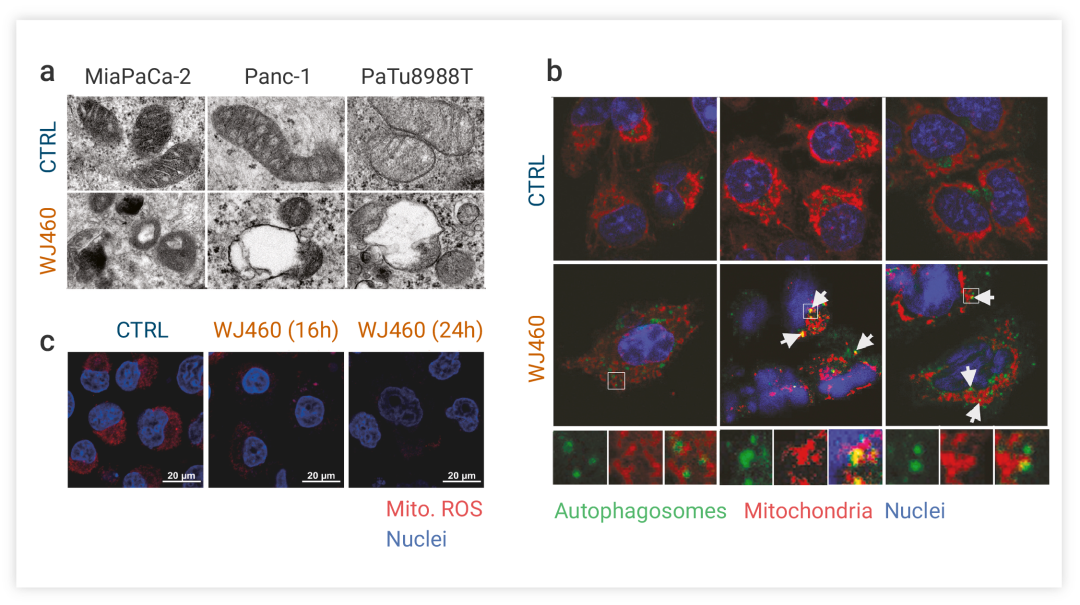
Myoferlin 是一種在多種癌癥中過度表達的癌蛋白,已有報道表明 Myoferlin 通過與線粒體動態機制的相互作用對胰腺癌的線粒體適應性有顯著貢獻[7]。為證明 Myoferlin 在 PDAC 細胞系中對線粒體自噬的影響,研究者使用了
WJ460 處
理 PDAC 細胞并進行線粒體形態觀察,如圖所示 WJ460 處理導致線粒體嵴結構紊亂,甚至出現空白區域
(圖 4a)。研究者還進行了對自噬體和線粒體進行了免疫定位:WJ460 處理的癌細胞中自噬體的數量增加,并且在 BxPC-3、Panc-1 和 PaTu 8988T 細胞系中發現了共定位點 (圖 4b)。此外,PDAC 在 WJ460 處理后,線粒體 ROS 豐度顯著降低 (圖 4c)。以上表明,在 PDAC 細胞系中,Myoferlin 的靶向抑制引起線粒體能量應激,并引發線粒體自噬。
圖 4. WJ460 在 PDAC 細胞誘導線粒體自噬[7]
a. 電鏡下觀察線粒體狀態。b. 免疫熒光共定位。c. 活性氧檢測
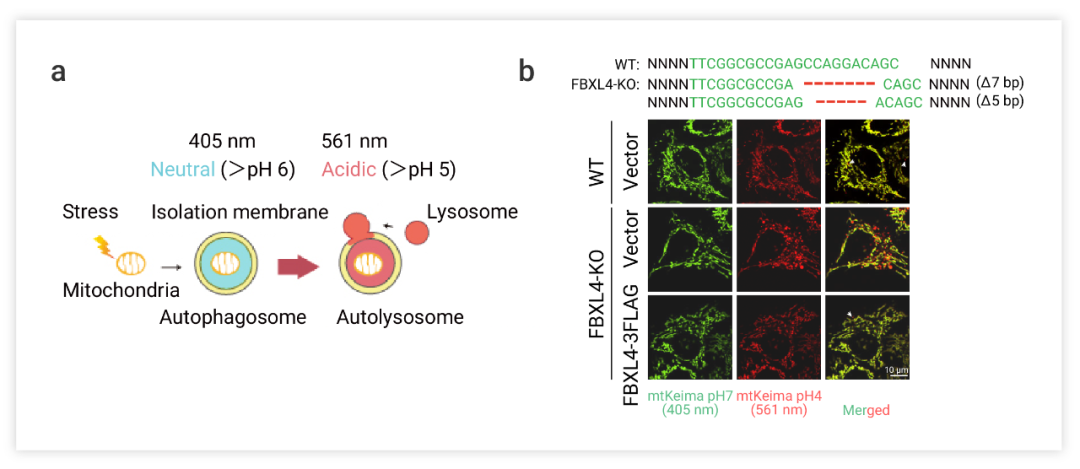
除上述線粒體形態觀察 (透射電鏡下線粒體受損情況),ROS 濃度測定線粒體內活性氧的積累,自噬體與線粒體免疫熒光共定位等方法,線粒體自噬的相關追蹤探針以及線粒體自噬標志物的 Western 檢測以及也是常用的檢測線粒體吞噬的方法[8]。如,在今年發表的A mitochondrial SCF-FBXL4 ubiquitin E3 ligase complexdegrades BNIP3 and NIX to restrain mitophagy and prevent mitochondrial disease 一文報道了關于線粒體自噬調控和線粒體疾病的研究。研究發現,在線粒體疾病 MTDPS13 中突變的蛋白 FBXL4 定位在線粒體外膜并發現 FBXL4 負調控線粒體自噬,抑制線粒體自噬的過度激活。作者團隊使用 mtKeima 報告基因分析了線粒體吞噬, mtKeima 是一種針對線粒體基質的 ph 敏感蛋白熒光蛋白,Keima 的激發光譜會隨 pH 值而變化(圖 5a)。
短波長在中性環境中的激發,而長波長會酸性環境激發,可用于區分游離線粒體和線粒體溶酶體。
圖 5. FBXL4-KO在HeLa細胞誘導線粒體自噬[9]
a. 探針追蹤機制的示意圖。b. 免疫熒光共定位
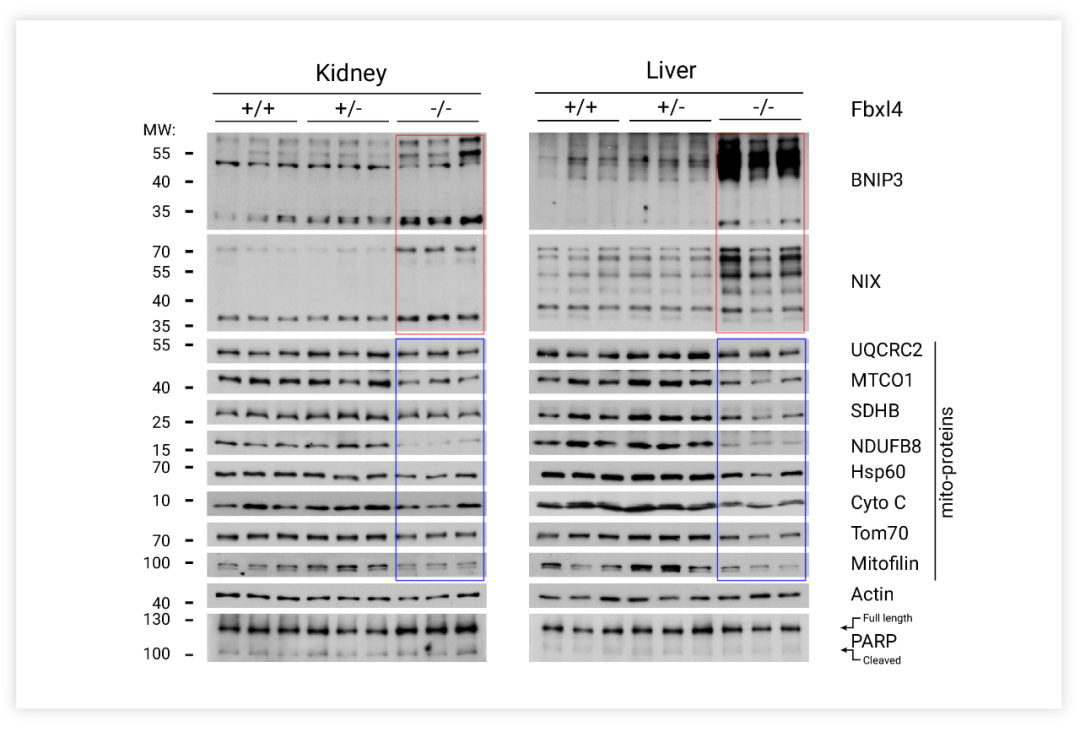
當線粒體被溶酶體吞噬時,Keima 會處在酸性環境,如圖在 Merged 圖中,黃綠色的 mtKeima 信號標記細胞質內的線粒體,紅色的 mtKeima 信號標記溶酶體內的線粒體自噬。FBXL4-KO 導致線粒體數量過少,激活了線粒體自噬。自噬過程中,參與線粒體自噬的蛋白 (PINK1、Parkin、BNIP3、Nix、FUNDC1) 水平在線粒體吞噬被激活后會增加。如圖 7 所示, Fbxl4-/-小鼠的組織樣本檢測出標記物蛋白 BNIP3 和 NIX 的積累、過度線粒體自噬和線粒體數量減少。
圖 6. Fbxl4-/- 小鼠組織樣本的Western 檢測[9]
■ 小結
線粒體自噬可謂是非“吃”不可,方式也是多種多樣,除了泛素依賴途徑 (PINK1/Parkin 通路為主) 和非泛素依賴途徑的經典機制。小M 還給大家介紹了線粒體自噬的一些常見檢測方法,希望能幫助到小伙伴們!
|
相關產品 |
|
線粒體電子傳遞鏈復合物 I 抑制劑。Rotenone 通過促進線粒體活性氧的產生來誘導細胞凋亡 。 |
|
線粒體中氧化磷酸化 (OXPHOS) 解偶聯劑。FCCP 誘導 PINK1 激活,促進 Parkin 在 Ser65 位點磷酸化。 |
|
線粒體 F0F1-ATPase 抑制劑,Oligomycin A 具有抗真菌的功能。 |
|
選擇性的發動蛋白相關蛋白 1 (Drp1) 抑制劑。Mdivi-1 是一種有效的線粒體分裂/線粒體自噬 (mitophagy) 抑制劑。 |
|
鞣花酸的腸道微生物代謝產物,具有抗炎、抗增殖和抗氧化的特性。Urolithin A 誘導自噬和凋亡,抑制細胞周期進程,抑制 DNA 合成。 |
|
通過增強 PINK1/Parkin 介導的線粒體自噬來保護多巴胺能神經元。 |
MCE 的所有產品僅用作科學研究或藥證申報,我們不為任何個人用途提供產品和服務
參考文獻
[1] Lu Y, et al. Cellular mitophagy: Mechanism, roles in diseases and small molecule pharmacological regulation. Theranostics. 2023;13(2):736-766.
[2] Lemasters JJ. Selective mitochondrial autophagy, or mitophagy, as a targeted defense against oxidative stress, mitochondrial dysfunction, and aging. Rejuvenation Res. 2005;8(1):3-5.
[3] Riley BE, Lougheed JC, Callaway K, et al. Structure and function of Parkin E3 ubiquitin ligase reveals aspects of RING and HECT ligases. Nat Commun. 2013;4:1982.
[4] Lazarou M, Sliter DA, Kane LA, et al. The ubiquitin kinase PINK1 recruits autophagy receptors to induce mitophagy. Nature. 2015;524(7565):309-314.
[5] Vargas JNS, Wang C, Bunker E, et al. Spatiotemporal Control of ULK1 Activation by NDP52 and TBK1 during Selective Autophagy. Mol Cell. 2019;74(2):347-362.e6.
[6] Qiu Y, Wang J, Li H, et al. Emerging views of OPTN (optineurin) function in the autophagic process associated with disease. Autophagy. 2022;18(1):73-85.
[7] Gilles Rademaker, et al. Myoferlin targeting triggers mitophagy and primes ferroptosis in pancreatic cancer cells. Redox Biol. 2022 Jul;53:102324.
[8] Tan HWS, Lu G, Dong H, et al. A degradative to secretory autophagy switch mediates mitochondria clearance in the absence of the mATG8-conjugation machinery. Nat Commun. 2022;13(1):3720. Published 2022 Jun 28.
[9]. Yu Cao, Jing Zheng, Huayun Wan, et al. A mitochondrial SCF-FBXL4 ubiquitin E3 ligase complex degrades BNIP3 and NIX to restrain mitophagy and prevent mitochondrial disease. EMBO J. 2023 Mar 10;e113033.
[10] Han R, Liu Y, Li S, Li XJ, Yang W. PINK1-PRKN mediated mitophagy: differences between in vitro and in vivo models [published online ahead of print, 2022 Nov 3]. Autophagy. 2022;1-10.
[11] Wang X, Winter D, Ashrafi G, et al. PINK1 and Parkin target Miro for phosphorylation and degradation to arrest mitochondrial motility. Cell. 2011;147(4):893-906.
[12] Huang E, Qu D, Huang T, et al. PINK1-mediated phosphorylation of LETM1 regulates mitochondrial calcium transport and protects neurons against mitochondrial stress. Nat Commun. 2017;8(1):1399. Published 2017 Nov 9.
[13] Yang W, Liu Y, Tu Z, et al. CRISPR/Cas9-mediated PINK1 deletion leads to neurodegeneration in rhesus monkeys. Cell Res. 2019;29(4):334-336.
[14] Yang W, Guo X, Tu Z, et al. PINK1 kinase dysfunction triggers neurodegeneration in the primate brain without impacting mitochondrial homeostasis. Protein Cell. 2022;13(1):26-46.
點擊化學:https://www.medchemexpress.cn/click-chemistry.html