瘧原蟲的生命周期和感染生物機制
瘧疾是一種蚊媒疾病,感染者通常會出現發燒、發冷和流感樣疾病。如果不及時治療,嚴重者甚至會危及生命。世衛組織新近發布的數據表明,2019 年全球估計發生 2.29 億瘧疾病例,死于該病的人數超過 40 萬例。
瘧疾是由感染人類的 5 種已知瘧原蟲中的任何一種引起的原生動物疾病:惡性瘧原蟲、間日瘧原蟲、三日瘧原蟲、卵形瘧原蟲、諾氏瘧原蟲。其中,在美洲和歐洲最常見的是間日瘧原蟲和三日瘧原蟲,在非洲是惡性瘧原蟲。
瘧原蟲生命周期主要分為兩個階段:即發生人類宿主內的無性繁殖和發生在蚊蟲媒介內的有性繁殖。
無性繁殖階段:雌性按蚊將含有子孢子 (sporozoites) 的唾液注入到人類宿主體內。在一小時內,這些子孢子進入血流并循環到肝臟,進而感染肝細胞 (肝細胞時期),在肝細胞內,每個子孢子無性復制形成數百個裂殖子。肝細胞破裂,裂殖子釋放到血液中,侵入紅細胞 (紅細胞周期)。
裂殖子經歷早期環狀滋養體 (ring)、晚期滋養體 (trophozoite),幾次有絲分裂形成裂殖體 (schizont) 階段。然后裂殖體破裂,將裂殖子釋放回血液中,在那里它們可以侵入新的紅細胞并參與紅細胞循環。
有性繁殖階段: 少數滋養體轉化為雄性和雌性配子體 (male/female gametocytes)。當雌性按蚊吸食受感染宿主的血液時,它會攝取這些配子體,這些配子體在蚊子體內進行有性循環,形成子孢子,完成瘧原蟲的生命周期。
引起癥狀性瘧疾的階段主要發生在瘧原蟲感染的紅細胞時期,在此做進一步的介紹。
入侵: 裂殖子和紅細胞之間的初始接觸是隨機的,但為了成功入侵,裂殖子使用肌動蛋白-肌球蛋白運動重新定向,使其頂端與紅細胞膜接觸。裂殖子與紅細胞的初始相互作用涉及到裂殖子表面蛋白 1 (MSP1),而重新定向后的頂端附著涉及寄生蟲特定入侵配體 (如 EBA 和 PfRh 家族成員) 和紅細胞表面受體相互作用。
除此之外,裂殖子和紅細胞的緊密連接,與瘧原蟲微粒蛋白 AMA1 和寄生蟲菱形頸 (RON) 蛋白形成的復合物也有關。
復制:一旦紅細胞感染被建立,寄生蟲迅速復制,在隨后的 48 小時內,裂殖體分裂,產生裂殖子,這些裂殖子在發育時逸出,導致紅細胞膜破壞和寄生蟲爆發性釋放,并入侵新的宿主細胞。
由于寄生蟲在迅速復制過程中需要持續的核苷酸庫來合成 DNA 和 RNA,因此,許多抗瘧藥靶向嘧啶生物合成。如靶向二氫葉酸還原酶 (DHFR) 的 Pyrimethamine、Cycloguanil,阻斷嘧啶生物合成的 Atovaquone,以及通過靶向 DHODH 來阻斷嘧啶的生物合成的 DSM265。
另外,寄生蟲對營養吸收的受損與 Na+ 的有害積累有關,而低等生物如寄生蟲的質膜 Na+ 輸出泵 (PfATP4),可以及時泵出積累的 Na+,從而維持 Na+ 穩態。另外,瘧原蟲 PI4K (如PfPI4K) 通過催化磷脂酰肌醇 (PI) 的磷酸啟動下游級聯通路,調節多種生物過程,包括在裂殖子發育過程中的信號轉導、膜運輸和胞質分裂。
值得一提的是,目前大部分抗瘧藥物都是靶向血液階段,如 Artemisinin 及其衍生物等都是有效的抗瘧藥物。

發病:主要的致病機制是瘧原蟲感染后,紅細胞發生溶血,釋放出寄生蟲和瘧疾內毒素 (被認為是瘧原蟲和寄生蟲 DNA 的復合物),進而激活 TLR9 觸發炎癥反應。此外,受感染的紅細胞的膜變硬而喪失變形能力,這種能力的喪失導致毛細血管阻塞,當重要器官受到影響時,嚴重時會危及生命。
總結:
就目前而言,瘧疾仍然是全球重大的疾病負擔。盡管 Artemisinin 及其衍生物是一線抗瘧藥物,Artemisinin 聯合療法效果更是十分顯著,但耐藥性寄生蟲的出現仍舊是個重要的問題。因此,需要開發新靶點的新型抗瘧藥,如基于紅細胞入侵需要一系列協調的蛋白質/蛋白質相互作用等。另外,與紅細胞表面的 basigin 相互作用的惡性瘧原蟲蛋白復合物 PfRH5、PfAMA1 等也可作為疫苗研究。要徹底消除人類瘧疾,我們仍有一段路要走。
MCE 的所有產品僅用作科學研究或藥證申報,我們不為任何個人用途提供產品和服務
參考文獻
1. Phillips MA, et al. Malaria. Nat Rev Dis Primers. 2017;3:17050.
2. Escalante AA, et al. Malaria Molecular Epidemiology: An Evolutionary Genetics Perspective. Microbiol Spectr. 2019;7(4):10.1128/microbiolspec. AME-0010-2019.
3. De Koning-Ward TF, et al. Plasmodium species: master renovators of their host cells. Nat Rev Microbiol. 2016;14(8):494-507.
4. Zheng Z, et al. Advances in Molecular Diagnosis of Malaria. Adv Clin Chem. 2017;80:155-192.
5. Cowman AF, et al. Malaria: Biology and Disease. Cell. 2016;167(3):610-624.
6. Mohandas N, et al. Malaria and human red blood cells. Med Microbiol Immunol. 2012;201(4):593-598.
7. Liang X, et al. Discovery of 6'-chloro-N-methyl-5'-(phenylsulfonamido)-[3,3'-bipyridine]-5-carboxamide (CHMFL-PI4K-127) as a novel Plasmodium falciparum PI(4)K inhibitor with potent antimalarial activity against both blood and liver stages of Plasmodium. Eur J Med Chem. 2020;188:112012.
8. Hisaeda H, et al. Malaria: immune evasion by parasites. Int J Biochem Cell Biol. 2005;37(4):700-706.
9. Osii RS, et al. The Impact of Malaria Parasites on Dendritic Cell-T Cell Interaction. Front Immunol. 2020;11:1597. Published 2020 Jul 24.
10. Yang J, et al. Advances in the research on the targets of anti-malaria actions of artemisinin. Pharmacol Ther. 2020;216:107697.
11. Delves M, et al. The activities of current antimalarial drugs on the life cycle stages of Plasmodium: a comparative study with human and rodent parasites. PLoS Med. 2012;9(2):e1001169.

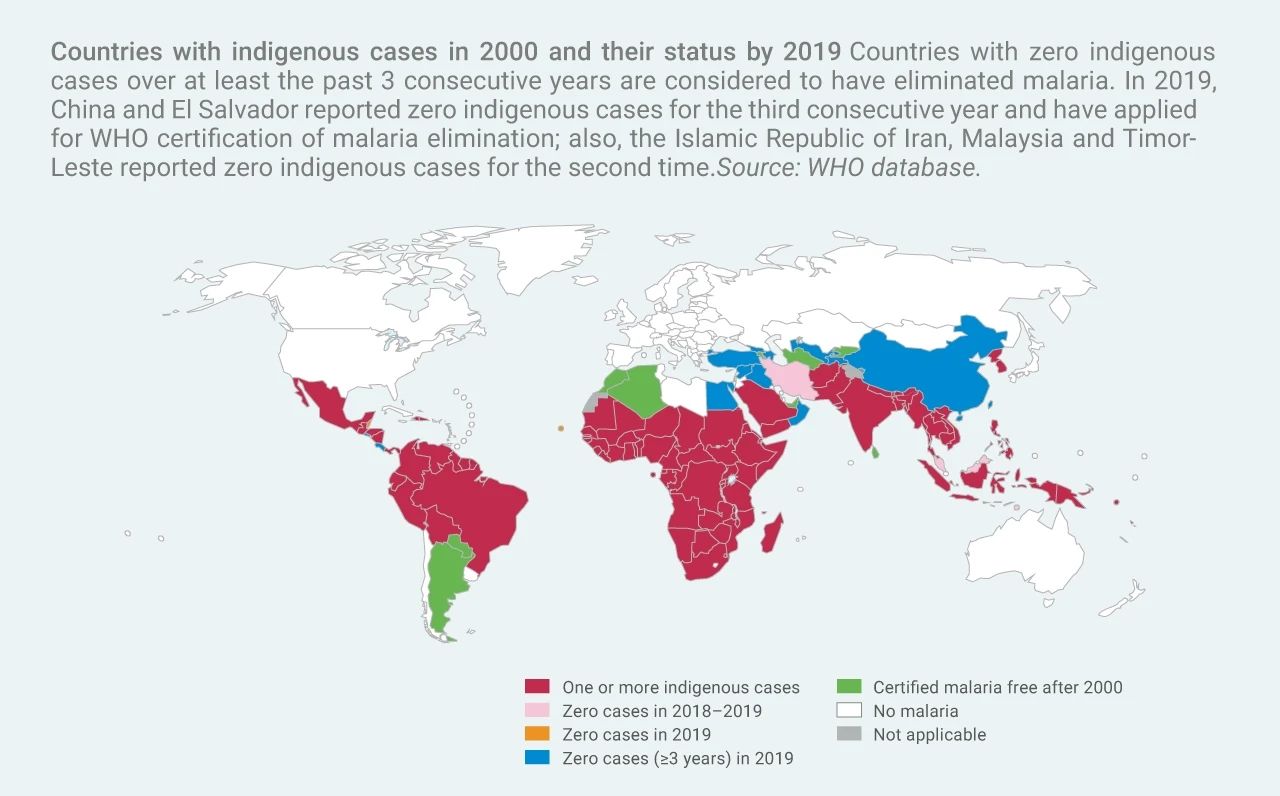
圖 1. 2000 年有病例的國家及其 2019 年情況 (WHO)[1]
瘧原蟲生命周期
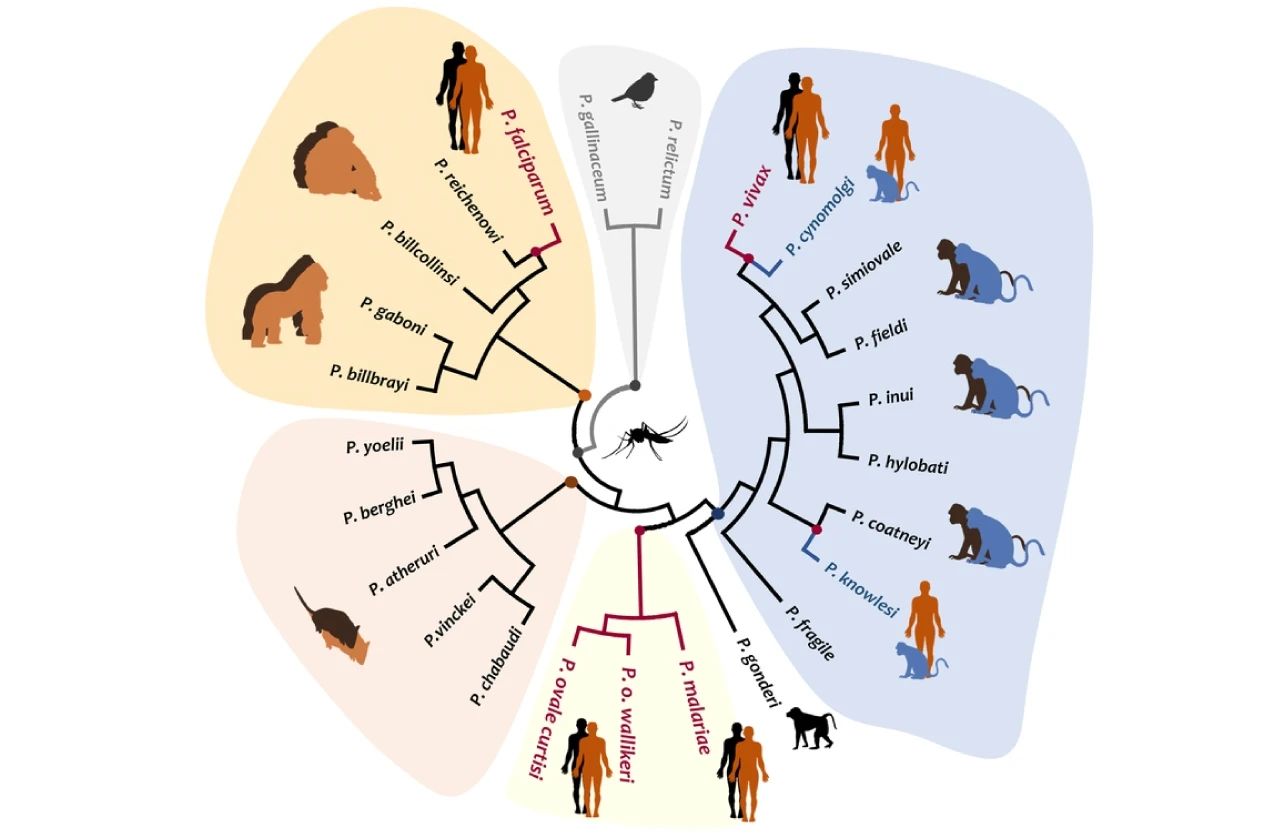
瘧疾是由感染人類的 5 種已知瘧原蟲中的任何一種引起的原生動物疾病:惡性瘧原蟲、間日瘧原蟲、三日瘧原蟲、卵形瘧原蟲、諾氏瘧原蟲。其中,在美洲和歐洲最常見的是間日瘧原蟲和三日瘧原蟲,在非洲是惡性瘧原蟲。

圖 2. 寄生于人類的瘧原蟲物種[2]
基于線粒體基因組的瘧原蟲系統發育樹
基于線粒體基因組的瘧原蟲系統發育樹
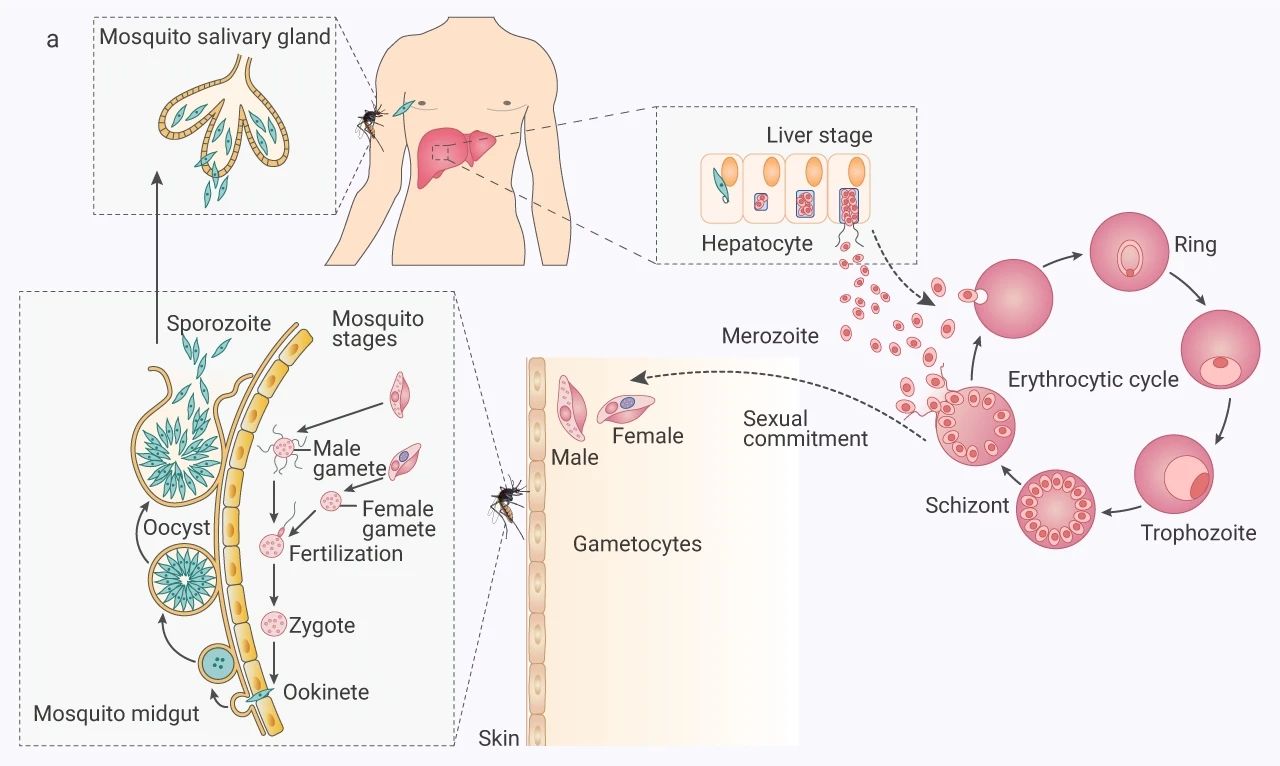
瘧原蟲生命周期主要分為兩個階段:即發生人類宿主內的無性繁殖和發生在蚊蟲媒介內的有性繁殖。
無性繁殖階段:雌性按蚊將含有子孢子 (sporozoites) 的唾液注入到人類宿主體內。在一小時內,這些子孢子進入血流并循環到肝臟,進而感染肝細胞 (肝細胞時期),在肝細胞內,每個子孢子無性復制形成數百個裂殖子。肝細胞破裂,裂殖子釋放到血液中,侵入紅細胞 (紅細胞周期)。
裂殖子經歷早期環狀滋養體 (ring)、晚期滋養體 (trophozoite),幾次有絲分裂形成裂殖體 (schizont) 階段。然后裂殖體破裂,將裂殖子釋放回血液中,在那里它們可以侵入新的紅細胞并參與紅細胞循環。
有性繁殖階段: 少數滋養體轉化為雄性和雌性配子體 (male/female gametocytes)。當雌性按蚊吸食受感染宿主的血液時,它會攝取這些配子體,這些配子體在蚊子體內進行有性循環,形成子孢子,完成瘧原蟲的生命周期。

圖 3. 瘧原蟲生命周期[3]
瘧原蟲感染生物機制
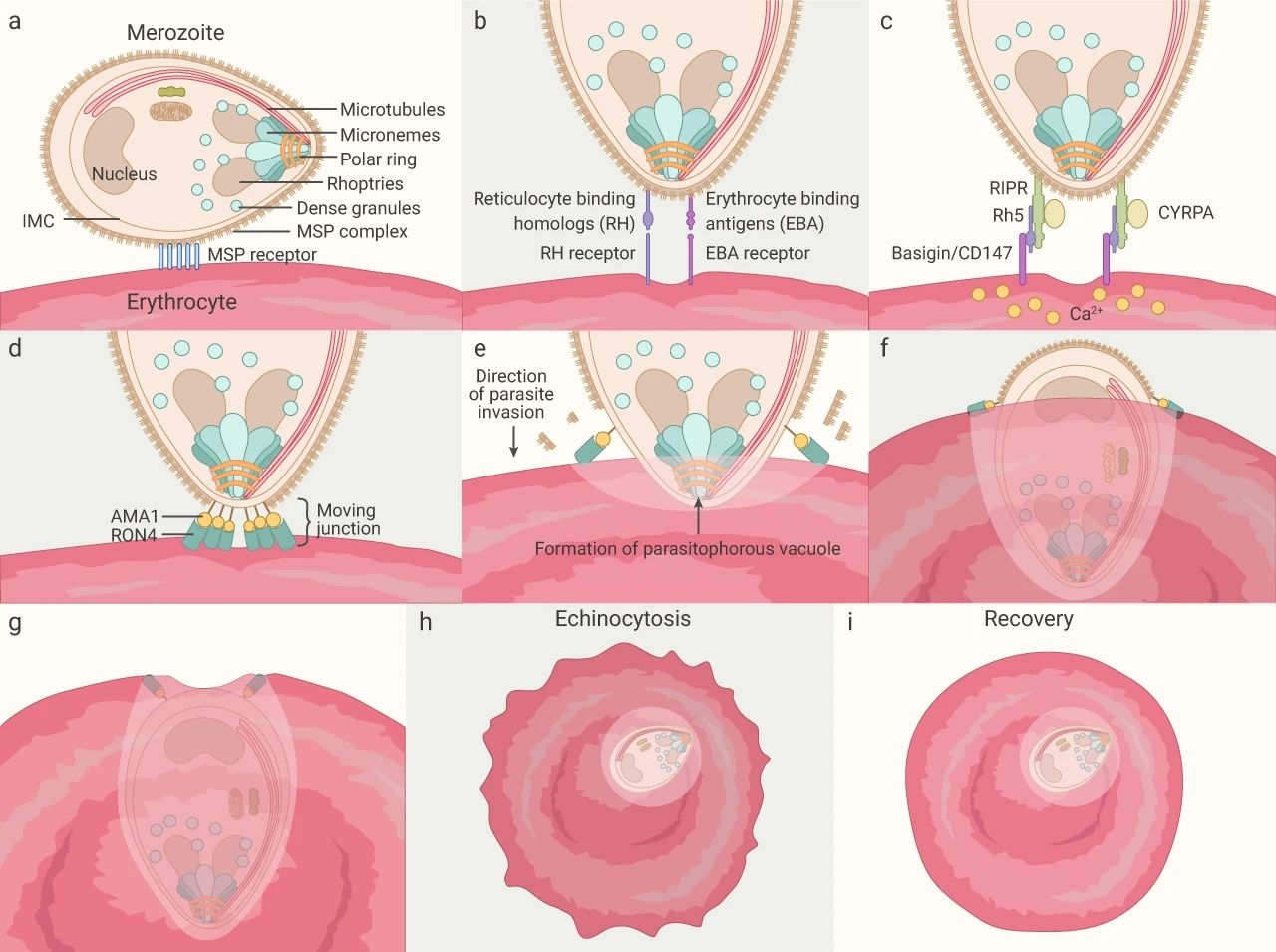
引起癥狀性瘧疾的階段主要發生在瘧原蟲感染的紅細胞時期,在此做進一步的介紹。
入侵: 裂殖子和紅細胞之間的初始接觸是隨機的,但為了成功入侵,裂殖子使用肌動蛋白-肌球蛋白運動重新定向,使其頂端與紅細胞膜接觸。裂殖子與紅細胞的初始相互作用涉及到裂殖子表面蛋白 1 (MSP1),而重新定向后的頂端附著涉及寄生蟲特定入侵配體 (如 EBA 和 PfRh 家族成員) 和紅細胞表面受體相互作用。
除此之外,裂殖子和紅細胞的緊密連接,與瘧原蟲微粒蛋白 AMA1 和寄生蟲菱形頸 (RON) 蛋白形成的復合物也有關。

圖 4. 裂殖子入侵步驟[5](a) 裂殖子重新定向。(b) 配體-受體相互作用,由 EBA 和 PfRh 家族成員的蛋白質介導。(c) PfRh5 復合物與受體 basigin的結合;(d-g) RON 復合物沉積到紅細胞膜中,與 AMA-1 直接結合形成移動連接,將裂殖子“推”入紅細胞膜,并形成寄生性液泡膜 (PVM)。(h-i) 紅細胞逐漸恢復穩態。
復制:一旦紅細胞感染被建立,寄生蟲迅速復制,在隨后的 48 小時內,裂殖體分裂,產生裂殖子,這些裂殖子在發育時逸出,導致紅細胞膜破壞和寄生蟲爆發性釋放,并入侵新的宿主細胞。
由于寄生蟲在迅速復制過程中需要持續的核苷酸庫來合成 DNA 和 RNA,因此,許多抗瘧藥靶向嘧啶生物合成。如靶向二氫葉酸還原酶 (DHFR) 的 Pyrimethamine、Cycloguanil,阻斷嘧啶生物合成的 Atovaquone,以及通過靶向 DHODH 來阻斷嘧啶的生物合成的 DSM265。
另外,寄生蟲對營養吸收的受損與 Na+ 的有害積累有關,而低等生物如寄生蟲的質膜 Na+ 輸出泵 (PfATP4),可以及時泵出積累的 Na+,從而維持 Na+ 穩態。另外,瘧原蟲 PI4K (如PfPI4K) 通過催化磷脂酰肌醇 (PI) 的磷酸啟動下游級聯通路,調節多種生物過程,包括在裂殖子發育過程中的信號轉導、膜運輸和胞質分裂。
值得一提的是,目前大部分抗瘧藥物都是靶向血液階段,如 Artemisinin 及其衍生物等都是有效的抗瘧藥物。

圖 5. 針對瘧原蟲生命周期不同階段的部分抗瘧藥[11]
宿主免疫反應和寄生蟲免疫逃避
寄生蟲具有破壞或逃避宿主免疫反應的能力,因此會發生重復感染。然而這種破壞的機制目前仍不清楚。有研究表明,寄生蟲能誘導樹突狀細胞 (DC) 功能失效,導致產生功能失調的 T 細胞。這些功能失調的 T 細胞無法遷移到淋巴結中的 B 細胞區域以幫助 B 細胞增殖和反應,從而減少了控制瘧疾感染所必需的抗體的產生。發病:主要的致病機制是瘧原蟲感染后,紅細胞發生溶血,釋放出寄生蟲和瘧疾內毒素 (被認為是瘧原蟲和寄生蟲 DNA 的復合物),進而激活 TLR9 觸發炎癥反應。此外,受感染的紅細胞的膜變硬而喪失變形能力,這種能力的喪失導致毛細血管阻塞,當重要器官受到影響時,嚴重時會危及生命。
總結:
就目前而言,瘧疾仍然是全球重大的疾病負擔。盡管 Artemisinin 及其衍生物是一線抗瘧藥物,Artemisinin 聯合療法效果更是十分顯著,但耐藥性寄生蟲的出現仍舊是個重要的問題。因此,需要開發新靶點的新型抗瘧藥,如基于紅細胞入侵需要一系列協調的蛋白質/蛋白質相互作用等。另外,與紅細胞表面的 basigin 相互作用的惡性瘧原蟲蛋白復合物 PfRH5、PfAMA1 等也可作為疫苗研究。要徹底消除人類瘧疾,我們仍有一段路要走。
| 相關產品 |
| Artemisinin 一種帶有過氧基團的倍半萜內酯和抗瘧疾劑。 |
| Chloroquine 通過干擾寄生蟲消化液泡 (food vacuole) 來殺死寄生蟲。 |
| Pyrimethamine 選擇性抑制瘧疾二氫葉酸還原酶胸苷酸合酶 (DHFR-TS),阻斷 DNA 合成。 |
| Cycloguanil Proguanil 的活性代謝產物,作用于紅細胞和肝細胞中的瘧疾裂殖體。 |
| Atovaquone 具有口服活性的選擇性寄生蟲線粒體細胞色素 bc1 復合物的抑制劑。 |
| Cipargamin 快速的抗瘧劑,抑制 PfATP4,對瘧原蟲的所有紅細胞內階段都有活性,并具有殺死配子細胞的活性,具有阻止傳播的潛力。 |
| MMV390048 瘧原蟲 PI4K 抑制劑。 |
| Antiparasitic Compound library 包含 250+ 具有明確抗寄生蟲作用的小分子化合物,可用于新適應癥的開發及新型抗寄生蟲靶點的鑒定。 |
參考文獻
1. Phillips MA, et al. Malaria. Nat Rev Dis Primers. 2017;3:17050.
2. Escalante AA, et al. Malaria Molecular Epidemiology: An Evolutionary Genetics Perspective. Microbiol Spectr. 2019;7(4):10.1128/microbiolspec. AME-0010-2019.
3. De Koning-Ward TF, et al. Plasmodium species: master renovators of their host cells. Nat Rev Microbiol. 2016;14(8):494-507.
4. Zheng Z, et al. Advances in Molecular Diagnosis of Malaria. Adv Clin Chem. 2017;80:155-192.
5. Cowman AF, et al. Malaria: Biology and Disease. Cell. 2016;167(3):610-624.
6. Mohandas N, et al. Malaria and human red blood cells. Med Microbiol Immunol. 2012;201(4):593-598.
7. Liang X, et al. Discovery of 6'-chloro-N-methyl-5'-(phenylsulfonamido)-[3,3'-bipyridine]-5-carboxamide (CHMFL-PI4K-127) as a novel Plasmodium falciparum PI(4)K inhibitor with potent antimalarial activity against both blood and liver stages of Plasmodium. Eur J Med Chem. 2020;188:112012.
8. Hisaeda H, et al. Malaria: immune evasion by parasites. Int J Biochem Cell Biol. 2005;37(4):700-706.
9. Osii RS, et al. The Impact of Malaria Parasites on Dendritic Cell-T Cell Interaction. Front Immunol. 2020;11:1597. Published 2020 Jul 24.
10. Yang J, et al. Advances in the research on the targets of anti-malaria actions of artemisinin. Pharmacol Ther. 2020;216:107697.
11. Delves M, et al. The activities of current antimalarial drugs on the life cycle stages of Plasmodium: a comparative study with human and rodent parasites. PLoS Med. 2012;9(2):e1001169.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





