單細胞力譜推動天然粘合劑納米藥物研發
腫瘤免疫療法已成為腫瘤治療中有效的策略。然而,如何在腫瘤部位實現局部化、持久的免疫刺激,同時有效對抗腫瘤的免疫抑制環境,仍是當前科學家們亟待解決的關鍵問題。近日,浙江大學的研究團隊在這一領域取得了突破性進展,創新性開發了一種基于天然貽貝粘附蛋白(NMPs)的納米藥物遞送系統,并借助多功能單細胞顯微操作技術- FluidFM,精確測量了納米藥物與細胞之間的粘附力,實時觀察了納米藥物與細胞的相互作用過程,為持久性免疫療法開辟了新路徑。

高水平文獻助力神器:多功能單細胞顯微操作系統- FluidFM OMNIUM
該研究成果以“A natural adhesive-based nanomedicine initiates photothermal-directed in situ immunotherapy with durability and maintenance”為題,發表于Biomaterials上。
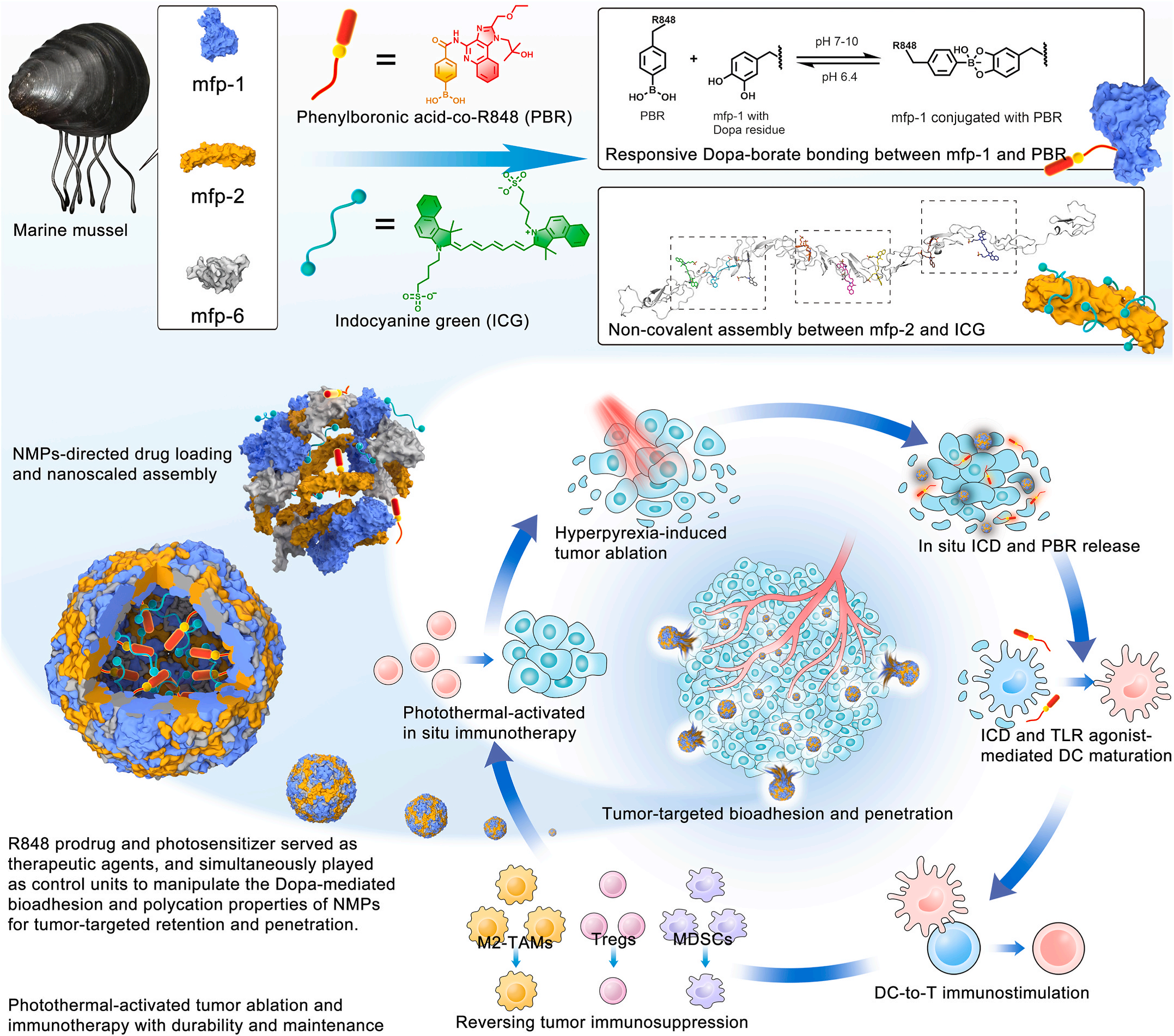
一、仿生粘附蛋白構建智能遞送系統
研究團隊從天然貽貝足蛋白中獲取靈感,利用其富含的3,4-二羥基苯丙氨酸(Dopa)成分所具備的氧化氫鍵雙重粘附機制,開發出具有超強粘附的NMPs材料,成為構建納米藥物遞送系統的超絕選擇。
研究團隊運用動態鍵合和非共價組裝技術,巧妙地把免疫佐劑前藥和光敏劑“裝進”了NMPs蛋白載體,構建了一種共遞送納米藥物。這種納米藥物能借助NMPs的生物粘附特性,精準地把藥物送到腫瘤部位,還能在特定時間和空間內控制藥物釋放,大大提高了治療效果。
當這種納米藥物遇到近紅外光,里面的光敏劑就會迅速產生光熱效應,直接“燒死”腫瘤細胞,同時引發免疫原性細胞死亡(ICD)。這一過程不僅消滅了腫瘤細胞,還釋放出大量腫瘤抗原和損傷相關分子模式(DAMPs)。這些物質就像“警報器”,激活了樹突狀細胞(DCs)等抗原呈遞細胞,進而啟動身體的適應性免疫應答,讓免疫系統對腫瘤發起攻擊。
二、調控免疫微環境,FluidFM顯神通
這種納米藥物不僅能直接殺傷腫瘤細胞,還能調節腫瘤免疫微環境。它能把腫瘤里那些抑制免疫反應的細胞(比如腫瘤相關巨噬細胞TAMs)重新“編程”,讓免疫系統更積極地對抗腫瘤。在這個過程中,FluidFM技術發揮了重要作用。
研究團隊用FluidFM技術精確測量了納米藥物與細胞之間的粘附力,了解了納米藥物在不同條件下的粘附性能以及對細胞行為的影響。這為優化納米藥物的設計和性能提供了重要依據。除了粘附力的測量,FluidFM還能實時觀察納米藥物與細胞的相互作用過程。通過這一前沿技術,研究人員發現納米藥物在酸性腫瘤微環境中會解離和碎片化,從而更好地滲透進腫瘤組織,延長在腫瘤里的停留時間。這一發現為納米藥物的進一步優化設計指明了方向。
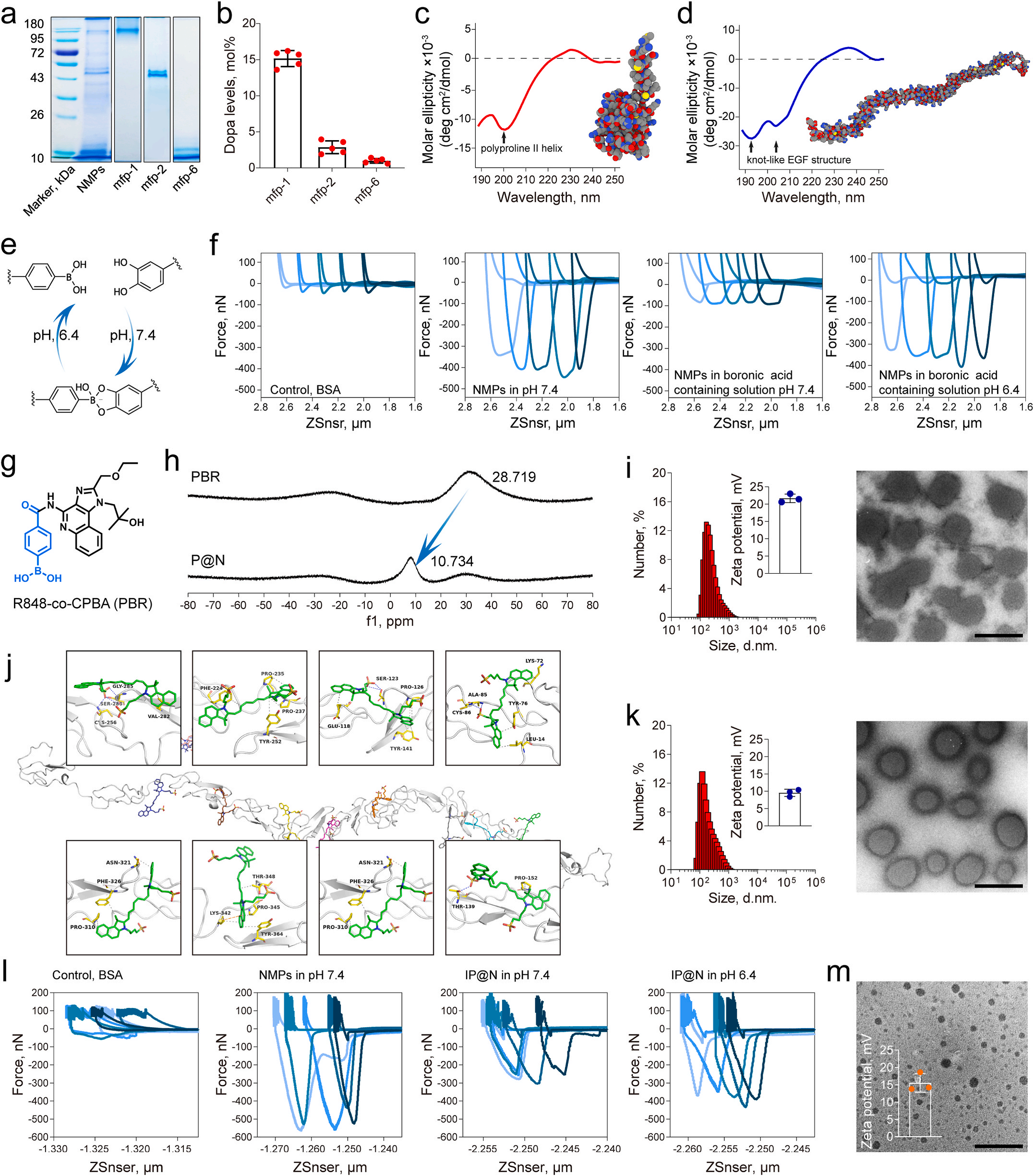
三、體內外實驗驗證卓越抗腫瘤效果
在體外實驗階段,研究團隊借助FluidFM等前沿技術,對納米藥物的各項關鍵性能展開了細致評估,包括生物粘附性、光熱轉換效率以及免疫刺激活性。實驗結果顯示,這款納米藥物展現出了優異的性能。它能夠顯著推動樹突狀細胞(DC)走向成熟,讓這些免疫系統的“哨兵”更好地識別和呈遞腫瘤抗原;同時,它還能有效活化T細胞,增強免疫系統對腫瘤細胞的攻擊能力。值得一提的是,納米藥物能夠對腫瘤相關巨噬細胞(TAMs)進行重編程,讓原本可能抑制免疫反應的TAMs“改邪歸正”,轉變為具有抗腫瘤功能的細胞,進一步增強了免疫系統對抗腫瘤的力量。
體內實驗環節,研究團隊將納米藥物通過靜脈注射的方式送入實驗動物體內。結果顯示,該納米藥物就像安裝了精準導航一樣,能夠特異性地靶向腫瘤部位,并且在腫瘤組織中長時間停留。在光熱照射的配合下,納米藥物發揮出強大的威力,高效地消融了腫瘤組織。不僅如此,它還誘導產生了持久的抗腫瘤免疫應答,讓免疫系統在腫瘤被消滅后依然保持警惕,防止腫瘤再次“卷土重來”。此外,借助FluidFM等技術的輔助觀測,研究團隊發現這款納米藥物在抑制腫瘤轉移和術后復發方面同樣表現出色,為腫瘤的綜合治療帶來了新的希望。
四、FluidFM 技術的創新優勢
FluidFM技術是瑞士Cytosurge公司將原子力系統、顯微成像系統、微流控系統、活細胞培養系統融為一體,研發出了多功能單細胞顯微操作系統-FluidFM OMNIUM。該系統可以輕松實現單個細胞水平、fL級別超高精度、全自動化的細胞操作。尤其是系統所具備的單細胞力譜功能,可在單細胞水平上提供高質量的力學數據,具有操作簡單、適用細胞種類廣、通量高、力學范圍寬等優勢。在本研究中,FluidFM技術發揮了不可或缺的作用,為納米藥物的研發和性能評估提供了關鍵支持。研究團隊利用該技術深入了解了在不同條件下的生物粘附性能,包括在中性或酸性環境中的表現。這些數據對于優化納米藥物的設計至關重要,確保了其在生理環境中的穩定性和在腫瘤部位的特異性粘附。
FluidFM技術還用于實時觀測納米藥物與細胞之間的相互作用過程。通過這一技術,研究團隊發現在酸性腫瘤微環境中能夠發生解離和碎片化,從而增強其在腫瘤組織中的滲透性和滯留時間。這一發現為納米藥物的優化設計提供了重要指導,有助于進一步提高其抗腫瘤效果。





