文獻(xiàn)解析:高深度免疫肽組學(xué)驅(qū)動(dòng)胰腺癌隱秘抗原挖掘
胰腺癌是一種對(duì)免疫療法反應(yīng)較差的實(shí)體瘤,其復(fù)雜的腫瘤免疫微環(huán)境和低突變負(fù)荷限制了傳統(tǒng)免疫治療的效果。近年來(lái),研究發(fā)現(xiàn)癌細(xì)胞能夠翻譯非編碼基因元件產(chǎn)生隱匿性(非典型)肽段,這些肽段可以被人類白細(xì)胞抗原I類(HLA-I)呈遞,并可能被T細(xì)胞識(shí)別。然而,這些隱匿性肽段在胰腺癌中的特性及其免疫原性尚未被充分研究。因此,深入探索胰腺癌中隱匿性肽段的呈遞機(jī)制和免疫原性,對(duì)于開(kāi)發(fā)新的免疫治療策略具有重要意義。
2025年5月8日,發(fā)表在《Science》上的最新研究“Pancreatic cancer–restricted cryptic antigens are targets for T cell recognition”,揭開(kāi)了胰腺癌中這些隱藏的秘密。研究通過(guò)高深度免疫肽組學(xué)技術(shù),在胰腺癌免疫肽組中鑒定出超過(guò) 1000 種隱秘抗原(ncHLAp),其中約 30%(517 種)為癌癥限制性隱秘抗原。這些肽主要來(lái)源于非編碼區(qū)域,且在 HLA 匹配患者中存在顯著共享性。通過(guò)體外 T 細(xì)胞平臺(tái)驗(yàn)證,36.3% 癌癥限制的ncHLAp 具有免疫原性,可誘導(dǎo)抗原特異性 T 細(xì)胞,其效率與突變新抗原相當(dāng),為胰腺癌的免疫治療提供了新的潛在靶點(diǎn)。
本研究采用高深度免疫肽組學(xué)技術(shù),對(duì)12例胰腺癌患者來(lái)源的類器官(PDOs)和腫瘤組織樣本進(jìn)行分析,結(jié)合NGS測(cè)序,鑒定出大量非典型(隱匿性)抗原肽。研究者通過(guò)結(jié)合單細(xì)胞RNA測(cè)序(scRNA-seq)數(shù)據(jù),篩選出具有癌癥特異性的隱匿性肽段。此外,研究者開(kāi)發(fā)了一套系統(tǒng),用于生成和功能鑒定能夠識(shí)別這些隱匿性肽段的T細(xì)胞受體(TCR),并通過(guò)CRISPR基礎(chǔ)的TCR重定向技術(shù)驗(yàn)證了這些TCR在體外和體內(nèi)對(duì)胰腺癌細(xì)胞的特異性殺傷能力。
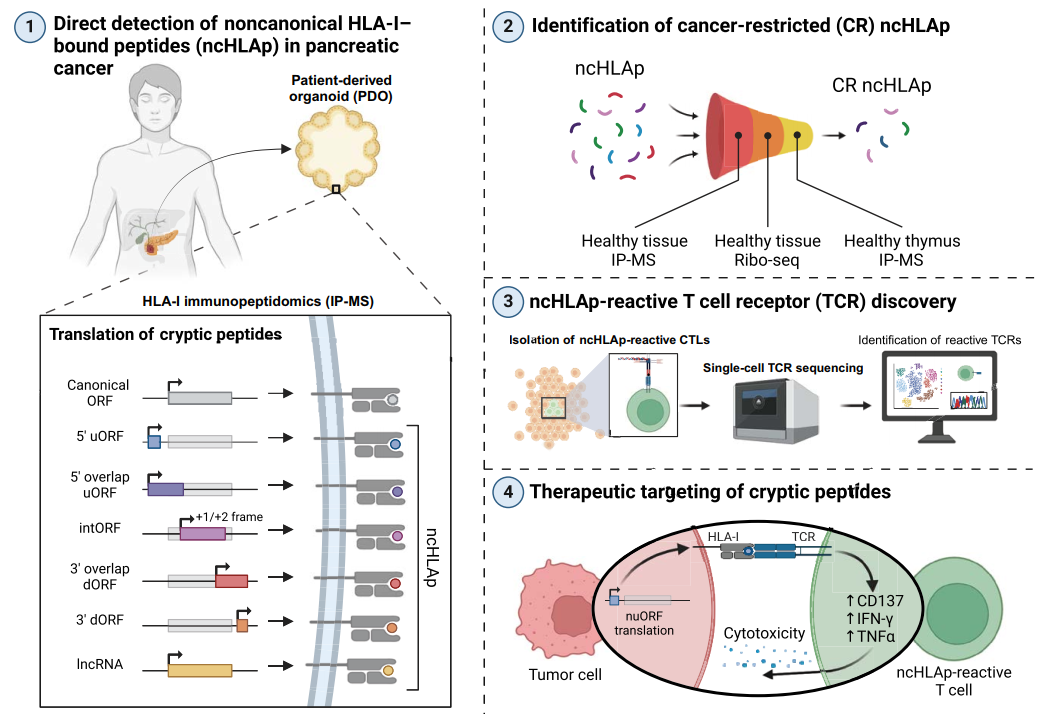
圖1. 研究方法概述
研究結(jié)果:一、胰腺癌深度免疫肽組的分析
研究者對(duì)12例PDAC PDOs進(jìn)行了深度免疫肽組分析,在 11 個(gè) PDOs 中鑒定出超 91,000 種 HLA 結(jié)合肽(HLAp),多數(shù)為 8-11 個(gè)氨基酸的短肽,符合 HLA-I 結(jié)合特征。與整塊腫瘤相比,PDOs 顯著減少基質(zhì)和免疫相關(guān)基因信號(hào),肽源基因模塊(PSGMs)在惡性細(xì)胞中特異性富集,而整塊腫瘤的 PSGMs 則廣泛分布于非惡性細(xì)胞,證實(shí)類器官能排除微環(huán)境干擾,精準(zhǔn)捕獲癌細(xì)胞肽組。
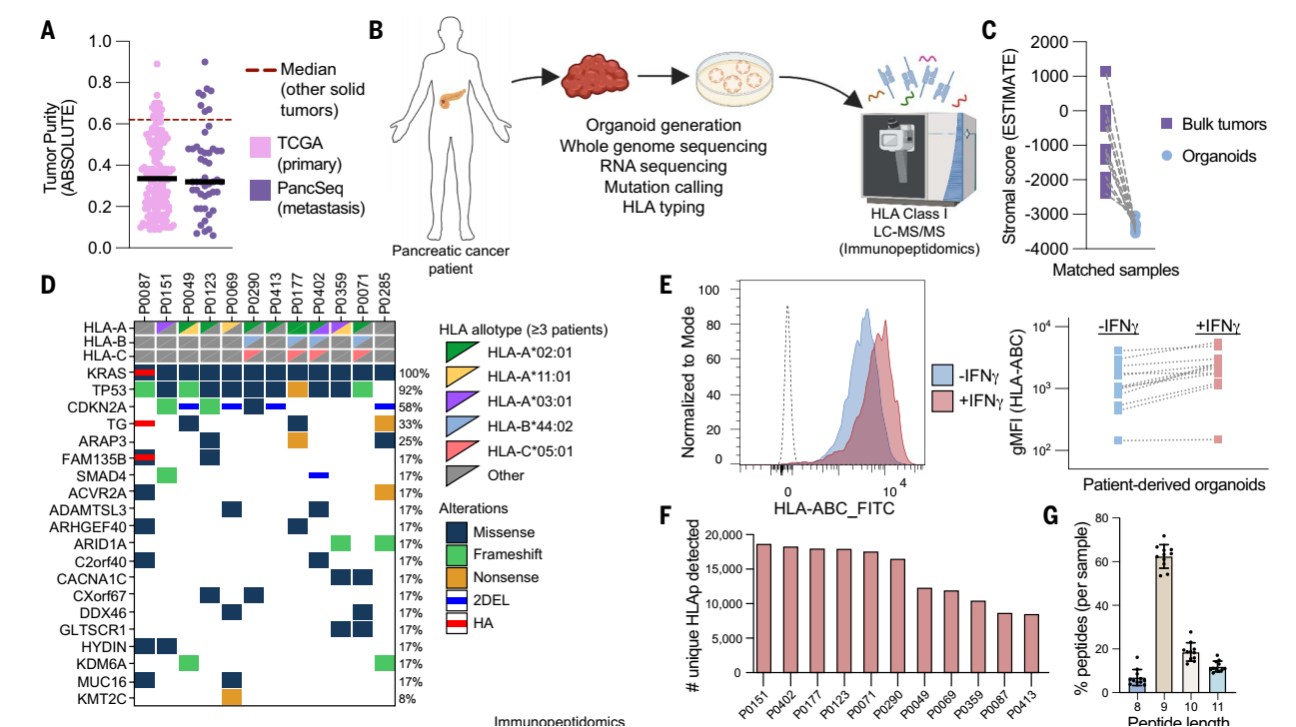
圖1.胰腺癌深度免疫肽組的檢測(cè)
二、胰腺癌中隱秘肽段的鑒定
首先,研究人員嘗試尋找傳統(tǒng)的靶點(diǎn)—突變來(lái)源的新抗原(mutHLAp)。對(duì) 11 例胰腺癌類器官(PDO)進(jìn)行免疫肽組學(xué)分析,結(jié)合患者特異性突變構(gòu)建質(zhì)譜搜索數(shù)據(jù)庫(kù),卻僅在 4 例樣本中檢測(cè)到 5 個(gè)突變新表位(mutHLAp),表明傳統(tǒng)突變新表位在胰腺癌中極為有限。接下來(lái),研究人員將注意力轉(zhuǎn)向了“隱秘抗原”(ncHLAp)。研究通過(guò)擴(kuò)展搜索空間至未注釋開(kāi)放閱讀框(nuORF)、保留內(nèi)含子等非編碼區(qū)域,鑒定出1,722 個(gè) ncHLAp,占免疫肽組的 2.2%-10.1%(中位數(shù) 5.1%)。
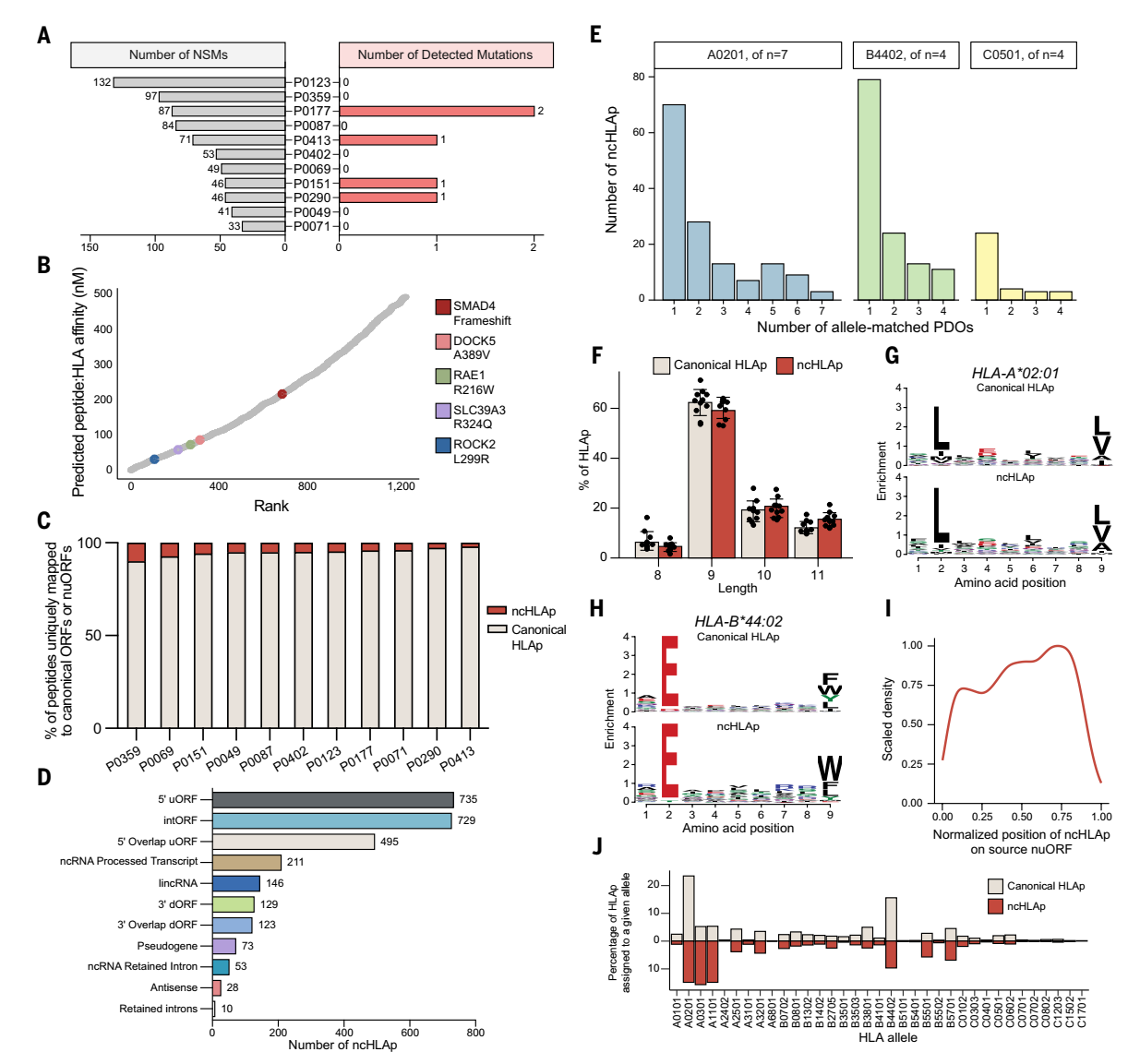
圖2.胰腺癌隱秘肽段的實(shí)證研究
為了評(píng)估ncHLAp的癌癥特異性,研究人員整合了28種健康組織的免疫肽組學(xué)數(shù)據(jù)、8種組織核糖體數(shù)據(jù)以及健康胸腺的免疫肽組學(xué)數(shù)據(jù)。對(duì)上述鑒定到的1712個(gè)ncHLAp進(jìn)行了系統(tǒng)篩選。結(jié)果顯示, 30%(517個(gè))的ncHLAp僅在胰腺癌中檢測(cè)到,而且在患者間有較高的共享性,這種共享性使其可能成為廣譜治療靶點(diǎn)。
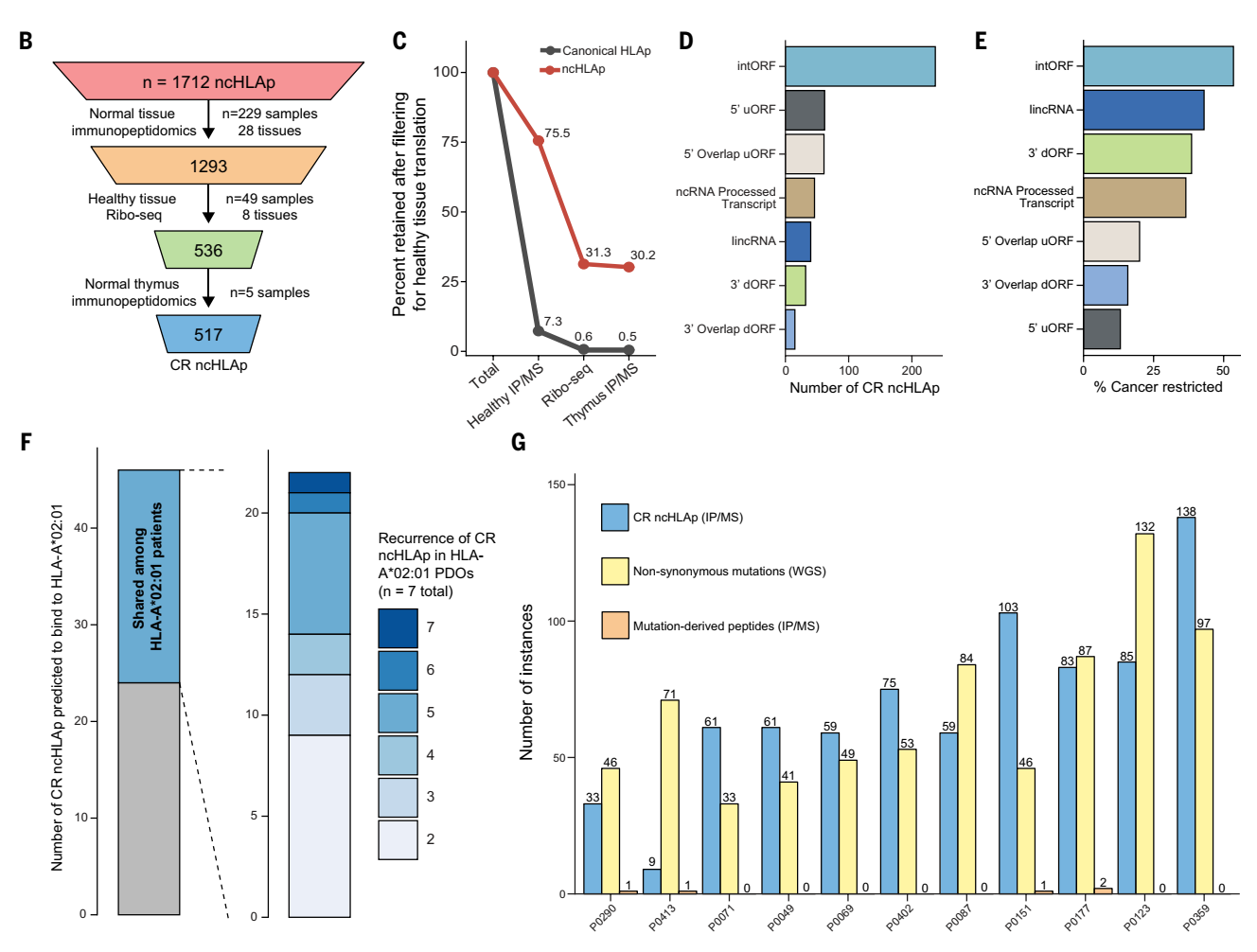
圖3. ncHLAp的癌癥限制性分析
四、胰腺癌限制性隱秘表位的免疫原性潛力
為評(píng)估胰腺癌限制性隱秘表位的免疫原性,研究利用體外 T 細(xì)胞啟動(dòng)與擴(kuò)增平臺(tái)。從健康人外周血單核細(xì)胞(PBMC)中分離單核細(xì)胞,誘導(dǎo)成樹(shù)突狀細(xì)胞(DC),通過(guò)將候選肽段負(fù)載于樹(shù)突狀細(xì)胞并激活 CD8+ T 細(xì)胞,系統(tǒng)評(píng)估了 56 個(gè) ncHLAp的免疫原性。結(jié)果顯示,36.3% 的 癌癥限制性的ncHLAp 可有效激活 T 細(xì)胞,而作為對(duì)照的非癌癥限制性的ncHLAp的免疫原性比例則顯著較低(8.7%)。并且,癌癥限制性的ncHLAp 的免疫原性與突變新表位(mutHLAp)相當(dāng)。
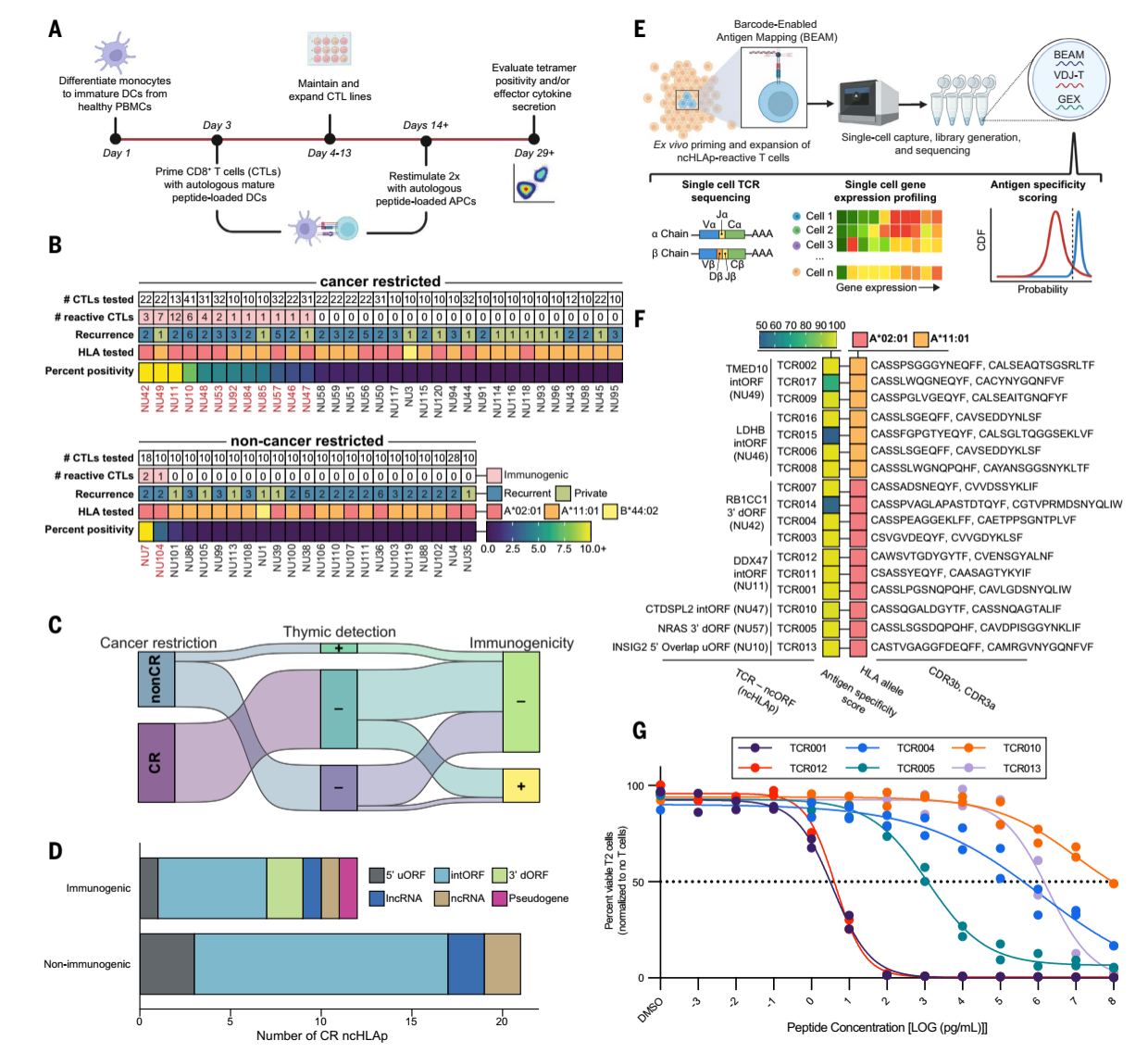
圖4.胰腺癌限制性隱秘表位的免疫原性潛力
五、靶向隱秘抗原的T細(xì)胞能識(shí)別并殺死胰腺癌類器官
研究人員通過(guò)單細(xì)胞TCR測(cè)序分離出17種癌癥限制性ncHLAp反應(yīng)性的T細(xì)胞受體(TCR),并利用CRISPR-Cas9技術(shù)構(gòu)建了TCR-T細(xì)胞。體外實(shí)驗(yàn)顯示,高親和力TCR-T細(xì)胞(如TCR001、TCR012)能顯著識(shí)別并殺傷表達(dá)ncHLAp的胰腺癌類器官(PDO),表現(xiàn)為IFN-γ分泌和CD137上調(diào)。體內(nèi)實(shí)驗(yàn)中,TCR001-T細(xì)胞顯著延緩NSG小鼠模型中的腫瘤生長(zhǎng)(P<0.001)。丙氨酸掃描實(shí)驗(yàn)證實(shí)了抗原-TCR結(jié)合的高度特異性。
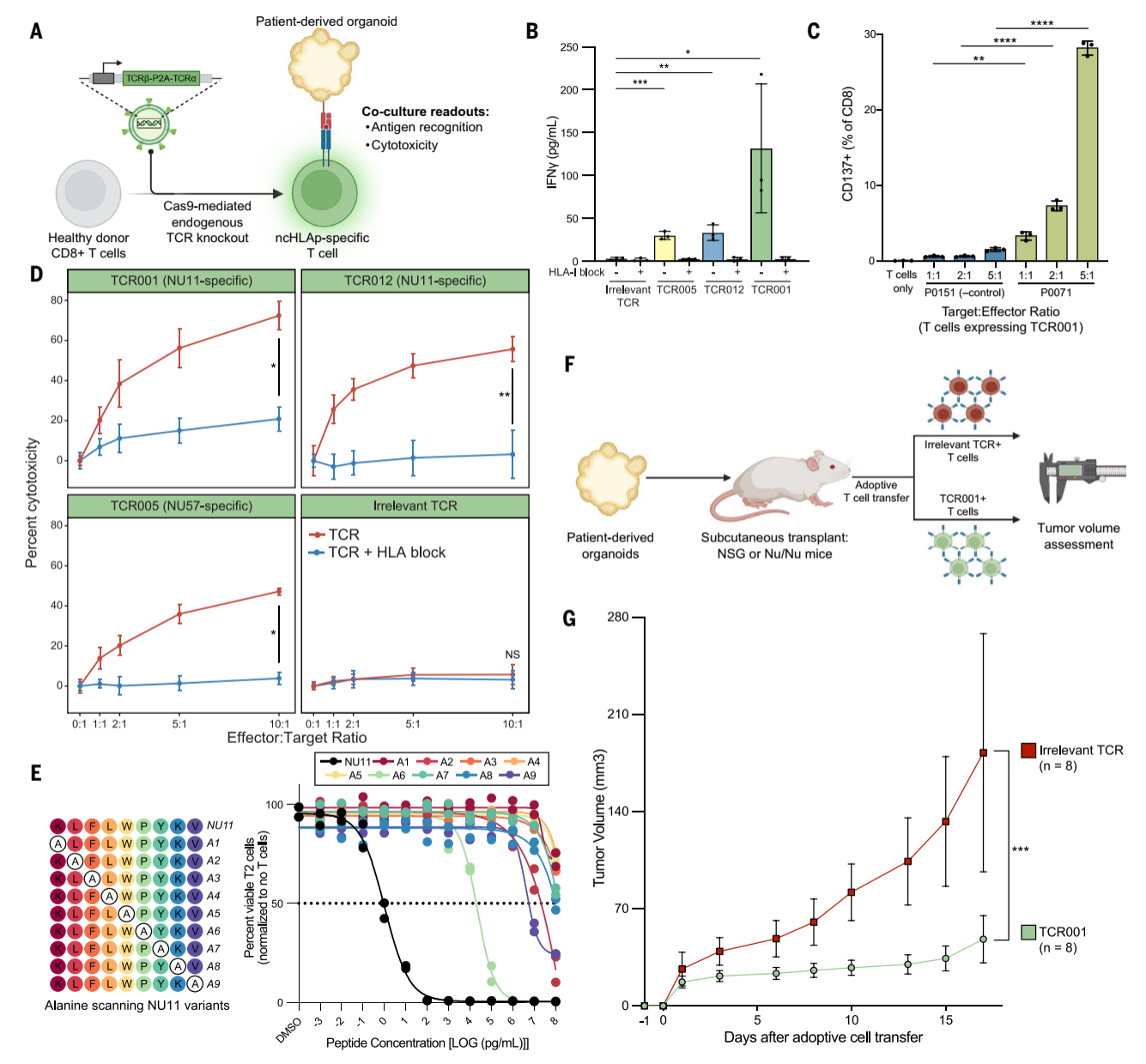
圖5. 癌癥限制性ncHLAp特異性T細(xì)胞驗(yàn)證
小結(jié):
這項(xiàng)研究不僅增進(jìn)了我們對(duì)胰腺癌中非典型抗原肽的理解,還為開(kāi)發(fā)針對(duì)這些肽段的免疫治療策略提供了重要的實(shí)驗(yàn)依據(jù)。通過(guò)識(shí)別和利用這些隱匿性抗原肽,未來(lái)可能開(kāi)發(fā)出更有效的胰腺癌治療方法,尤其是在那些對(duì)傳統(tǒng)免疫療法反應(yīng)不佳的患者中。
- 文獻(xiàn)解析:高深度免疫肽組學(xué)驅(qū)動(dòng)胰腺癌隱秘抗原挖掘
- Elispot(酶聯(lián)免疫斑點(diǎn)檢測(cè))樣本制備介紹
- 百蓁生物全面解碼豬免疫肽組研究,賦能疫苗開(kāi)發(fā)和瘟病防控
- 調(diào)控RNA的作用機(jī)制及應(yīng)用
- 免疫肽組學(xué)助力結(jié)直腸癌新生抗原與細(xì)菌抗原的發(fā)現(xiàn)
- 單分子陣列Simoa技術(shù)助力腦-體連接研究
- H5N1禽流感病毒感染風(fēng)險(xiǎn)與早期檢測(cè)方法
- CDR3工程與中和抗體定制:保證型抗體重塑治療新標(biāo)準(zhǔn)
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





