細胞劃痕實驗常用方法及聯用箱內成像設備新方法分享
細胞劃痕實驗是檢測細胞活力的常見實驗之一。細胞劃痕實驗常用方法是在人為劃線的基礎上加顯微鏡觀察。此方法需頻繁拿出細胞,那么有什么新方法可以彌補這種不足呢?本文將介紹一種新方法-使用活細胞成像系統,置于培養箱內實時動態成像,監測細胞變化情況。我們分析了新方法對比常用方法的優勢,同時列舉了幾篇活細胞成像分析系統應用在細胞劃痕方向的高分文章,這些文章發表于《Materials & Design》《Science Immunology》等期刊。該方法獲得了科研人員的認可,且在細胞劃痕實驗中被廣泛使用,新方法的可靠性得到了證實。
細胞劃痕實驗(Cell scratch assay),是分析細胞遷移能力常用的方法實驗。
“細胞遷移(Cell migration)又被稱為細胞運動、細胞爬行或細胞移動,當細胞接收到遷移信號或感受到某物質濃度梯度后會產生遷移現象。”簡單來說,細胞遷移就是細胞的移動。
在很多生理或病理活動中都涉及到細胞遷移,如發育、免疫反應、傷口愈合和癌癥轉移等。了解細胞遷移過程至關重要,它能夠為疾病診斷和藥物開發等應用提供理論基礎。
當細胞鋪滿整個孔板時,在融合的單層細胞上人為劃出一條直線,該直線部分稱為“劃痕”。繼續培養劃痕邊緣的細胞會逐漸向空白區域生長,“劃痕”逐漸愈合。整個過程類似于傷口愈合,故該實驗又可稱為傷口愈合實驗(Wound healing assay)。從劃線開始捕獲圖像,到整個過程結束,通過測量并計算不同時間點的劃痕間距差值來估測該細胞的遷移能力。細胞遷移實驗可用來觀察藥物、基因等外源因素對細胞遷移、修復和相互作用的影響。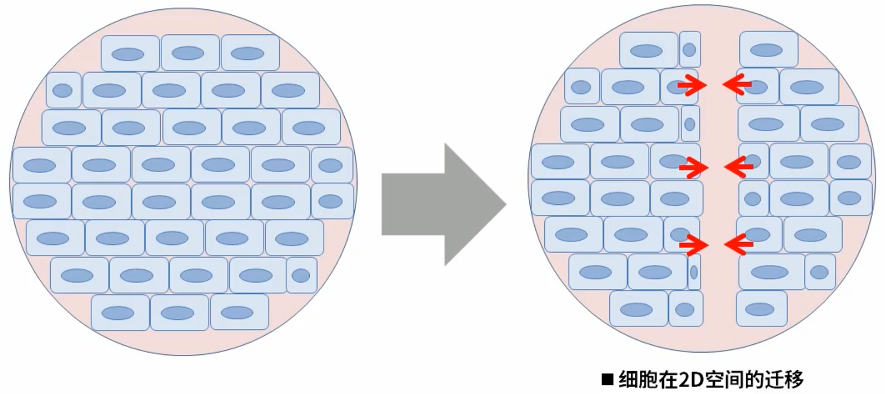
具體操作步驟:
劃痕實驗操作注意事項:
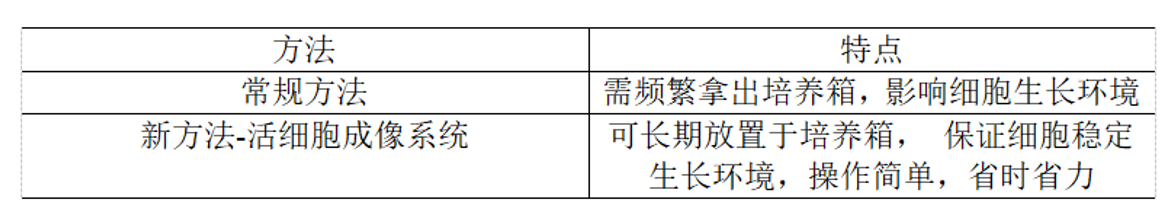
上述實驗步驟為常規實驗室操作,不足之處在于對細胞遷移進行計算,要頻繁拿取細胞樣本在顯微鏡下觀察,拍照記錄結果。操作繁瑣,耗時費力,實驗成功率不能保證,最終影響實驗效率。
那么有什么新工具可以彌補這些不足,助力于細胞劃痕實驗呢?
奎克泰生物的JuLI系列實時活細胞成像系統能夠放置于培養箱內,實時觀察、拍攝記錄細胞變化的全過程,實現細胞計數、監測、拍照、形成視頻、融合度、等功能。此外,JuLI Stage可選配劃痕設備,為96孔板生成統一的劃痕,利用配套的劃痕軟件實時分析劃痕。 實驗人員可以預先設定好拍攝總時長和間隔時間,通過延時攝影監測并評估細胞遷移情況,提供細胞遷移量化結果。
實驗人員可以預先設定好拍攝總時長和間隔時間,通過延時攝影監測并評估細胞遷移情況,提供細胞遷移量化結果。
對比于傳統細胞劃痕實驗操作,JuLI系列實時活細胞成像系統能大大縮減人工操作的繁瑣性,提高實驗結果的準確性、成功率,為實驗提供便利性。
以下來自世界各權威機構發表的文章中,均為使用JuLI系列活細胞成像系統做的細胞劃痕實驗: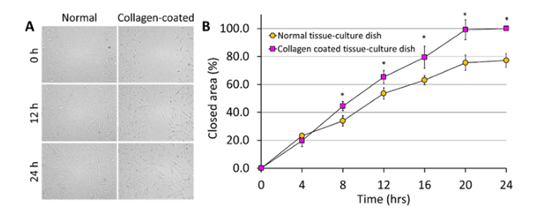
2.來自韓國加川醫科大學解剖學系的研究團隊在《Experimental & Molecular Medicine》期刊發表題為“Proangiogenic functions of an RGD-SLAY-containing osteopontin icosamer peptide in HUVECs and in the postischemic brain”的文章,研究人員在HUVECs細胞上制造劃痕,用不同藥物處理細胞,使用JuLI™ Stage進行拍攝,最終呈現第0 h和第12 h的拍攝結果。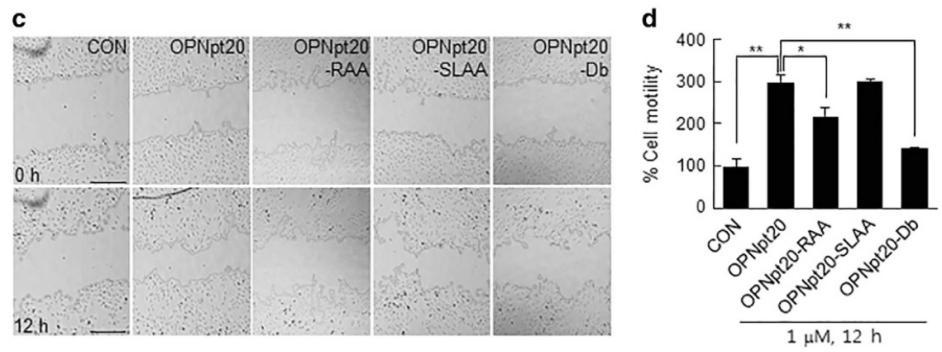
3.來自英國帝國理工學院心肺研究所的研究團隊在《Science Immunology》期刊發表題為“Itaconate controls the severity of pulmonary fibrosis”的文章,研究人員在用衣康酸鹽或不用衣康酸鹽處理的情況下,使用JuLI™ Stage拍攝60h,監測HLF細胞的傷口愈合能力。數據結果顯示暴露于衣康酸鹽后,HLF細胞的傷口愈合能力顯著降低。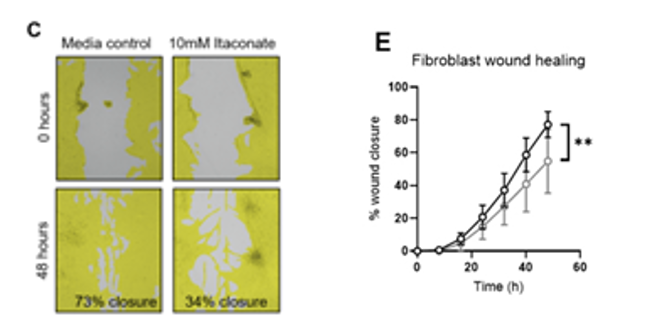
還有更多使用案例等您發現,有心動么?
關注奎克泰生物,后面我們將繼續向大家科普關于實驗方面的小知識。
參考文獻:
[1]Lee J Y, Park J H, Ahn M J, et al. Long-term study on off-the-shelf tracheal graft: A conceptual approach for urgent implantation[J]. Materials & Design, 2020, 185: 108218. (IF8.4)
[2]Lee H, Jin YC, Kim SW, Kim ID, Lee HK, Lee JK. Proangiogenic functions of an RGD-SLAY-containing osteopontin icosamer peptide in HUVECs and in the postischemic brain[J]. Experimental and Molecular Medicine,2018,50(S10). (IF12.8)
[3]Ogger P P, Albers G J, Hewitt R J, et al. Itaconate controls the severity of pulmonary fibrosis[J].
Science Immunology, 2020, 5(52): eabc1884. (IF24.8)
細胞劃痕實驗(Cell scratch assay),是分析細胞遷移能力常用的方法實驗。
“細胞遷移(Cell migration)又被稱為細胞運動、細胞爬行或細胞移動,當細胞接收到遷移信號或感受到某物質濃度梯度后會產生遷移現象。”簡單來說,細胞遷移就是細胞的移動。
在很多生理或病理活動中都涉及到細胞遷移,如發育、免疫反應、傷口愈合和癌癥轉移等。了解細胞遷移過程至關重要,它能夠為疾病診斷和藥物開發等應用提供理論基礎。
當細胞鋪滿整個孔板時,在融合的單層細胞上人為劃出一條直線,該直線部分稱為“劃痕”。繼續培養劃痕邊緣的細胞會逐漸向空白區域生長,“劃痕”逐漸愈合。整個過程類似于傷口愈合,故該實驗又可稱為傷口愈合實驗(Wound healing assay)。從劃線開始捕獲圖像,到整個過程結束,通過測量并計算不同時間點的劃痕間距差值來估測該細胞的遷移能力。細胞遷移實驗可用來觀察藥物、基因等外源因素對細胞遷移、修復和相互作用的影響。

(圖片來源:CSDN博客 分子生物學專欄)
具體操作步驟:
1.準備細胞,將貼壁細胞用胰酶消化下來,制備成細胞懸液。
2.細胞計數后,進行鋪板。每孔加入合適細胞,等待細胞長滿整個孔板。
3.選擇10μL或者200μL的槍頭,借助直尺進行劃線,產生細胞劃痕。
4.用PBS輕輕洗去細胞碎片,加入無血清培養基或者低血清培養基,放入培養箱之前拍照記錄。
5.拍照觀察,每隔一定時間對樣本進行拍照記錄,計算細胞的遷移率。
劃痕實驗操作注意事項:
1.開展劃痕實驗,原則上細胞要鋪滿整個孔板底部再進行劃線,否則會影響后續實驗結果分析。
2.同種細胞劃線最好使用同一個槍頭,減小劃痕寬度的誤差(人工劃線難免產生誤差,可借助設備進行劃線)。
3.PBS沖洗時動作輕柔,避免將其他貼壁細胞洗去。反復清洗,將細胞碎片去除。
4.選用無血清培養基或者低血清培養基對細胞進行培養。為減少細胞增殖對遷移的影響,可加入絲裂霉素處理細胞,抑制細胞的分裂。
上述實驗步驟為常規實驗室操作,不足之處在于對細胞遷移進行計算,要頻繁拿取細胞樣本在顯微鏡下觀察,拍照記錄結果。操作繁瑣,耗時費力,實驗成功率不能保證,最終影響實驗效率。
那么有什么新工具可以彌補這些不足,助力于細胞劃痕實驗呢?
奎克泰生物的JuLI系列實時活細胞成像系統能夠放置于培養箱內,實時觀察、拍攝記錄細胞變化的全過程,實現細胞計數、監測、拍照、形成視頻、融合度、等功能。此外,JuLI Stage可選配劃痕設備,為96孔板生成統一的劃痕,利用配套的劃痕軟件實時分析劃痕。


對比于傳統細胞劃痕實驗操作,JuLI系列實時活細胞成像系統能大大縮減人工操作的繁瑣性,提高實驗結果的準確性、成功率,為實驗提供便利性。
以下來自世界各權威機構發表的文章中,均為使用JuLI系列活細胞成像系統做的細胞劃痕實驗:
1.來自韓國科學技術大學機械工程系的研究團隊在《Materials & Design》期刊發表題為“Long-term study on off-the-shelf tracheal graft: A conceptual approach for urgent implantation”的文章,研究人員在hTMSCs細胞單層上直接劃傷,使用JuLI™ Br觀察細胞向創面的遷移情況。監測總時長24h,每隔4h拍攝一次圖像。

2.來自韓國加川醫科大學解剖學系的研究團隊在《Experimental & Molecular Medicine》期刊發表題為“Proangiogenic functions of an RGD-SLAY-containing osteopontin icosamer peptide in HUVECs and in the postischemic brain”的文章,研究人員在HUVECs細胞上制造劃痕,用不同藥物處理細胞,使用JuLI™ Stage進行拍攝,最終呈現第0 h和第12 h的拍攝結果。

3.來自英國帝國理工學院心肺研究所的研究團隊在《Science Immunology》期刊發表題為“Itaconate controls the severity of pulmonary fibrosis”的文章,研究人員在用衣康酸鹽或不用衣康酸鹽處理的情況下,使用JuLI™ Stage拍攝60h,監測HLF細胞的傷口愈合能力。數據結果顯示暴露于衣康酸鹽后,HLF細胞的傷口愈合能力顯著降低。

還有更多使用案例等您發現,有心動么?
關注奎克泰生物,后面我們將繼續向大家科普關于實驗方面的小知識。
參考文獻:
[1]Lee J Y, Park J H, Ahn M J, et al. Long-term study on off-the-shelf tracheal graft: A conceptual approach for urgent implantation[J]. Materials & Design, 2020, 185: 108218. (IF8.4)
[2]Lee H, Jin YC, Kim SW, Kim ID, Lee HK, Lee JK. Proangiogenic functions of an RGD-SLAY-containing osteopontin icosamer peptide in HUVECs and in the postischemic brain[J]. Experimental and Molecular Medicine,2018,50(S10). (IF12.8)
[3]Ogger P P, Albers G J, Hewitt R J, et al. Itaconate controls the severity of pulmonary fibrosis[J].
Science Immunology, 2020, 5(52): eabc1884. (IF24.8)
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





