║¾PD-1òr┤·┬ô(li¿ón)║¤Í╬»ƒÁ─9éÇ▓▀┬È
1. ┬ô(li¿ón)║¤╗»»ƒ
╗»»ƒıTîº(d¿úo)Á─░®╝Ü░¹╦└═÷ú¼┤┘▀M─[┴÷┐╣È¡Á─ßîÀ┼║═┐╣È¡Á─│╩▀fú¼╝ñ╗¯├ÔÊ▀ðºæ¬(y¿®ng)╝Ü░¹íú
─[┴÷┐sðí▓╗âH┐╔─▄¢o├ÔÊ▀Í╬»ƒ©³ÂÓÁ─╣ñθòrÚgú¼Â°ÃÊ▀Ç┐╔ÊÈ¢ÁÁ═─═╦Ä┐╦┬í«a(ch¿ún)╔·Á─┐╔─▄ðÈíú
*ÐË╔ÛÚåÎxú║├ÔÊ▀È¡ðÈ╝Ü░¹╦└═÷ú¿immunogenic cell deathú¼ICDú®
│╔╣ª░©└²
├ÔÊ▀Öz▓Ú³cÊÍÍãä®┬ô(li¿ón)║¤ÿ╦£╩╗»»ƒÊÐ│╔╣ªË├Ë┌ÀÃðí╝Ü░¹À╬░®ú¿KEYNOTE-189ú¼IMpower130ú®íóðí╝Ü░¹À╬░®ú¿KEYNOTE-407ú¼IMpower133ú®║═╚²ÛÄðÈ╚Ú¤┘░®ú¿KEYNOTE-355ú¼IMpassion13ú®íú

┬ô(li¿ón)║¤ADC╦Ä╬´Ê▓È┌╠¢╦¸Íð...
È┌È¡╬╗HER2ÛûðÈ─úð═Íðú¼T╝Ü░¹ÃÕ│²¢ÁÁ═┴╦T-DM1Í╬»ƒðí╩¾Á─┐é╔·┤µ┬╩ú¼▀@▒Ý├¸├ÔÊ▀À┤æ¬(y¿®ng)îªT-DM1Á─»ƒðº║▄ÍÏʬíúÙm╚╗┬ô(li¿ón)║¤╩╣Ë├PD-1║═CTLA-4┐╣¾wÈ┌Èô─úð═Íðƒoðºú¼Á½╦³éâ┼cT-DM1Á─┬ô(li¿ón)║¤╩╣Ë├àsÀÃ│úËððºíú╗¨Ë┌▀@ð®öÁ(sh¿┤)ô■(j¿┤)ú¼Ê╗ð®ADCı²È┌╠¢╦¸¢Y(ji¿ª)║¤├ÔÊ▀Í╬»ƒíú
2. ┬ô(li¿ón)║¤░ð¤‗Í╬»ƒ
▀^╚Ñ╬Õ─ÛÍðú¼PD-1/PD-L1┐╣¾w║═░ð¤‗Í╬»ƒ▀Mðð┴╦ÂÓÀN┬ô(li¿ón)║¤Í╬»ƒÁ─çLÈçíú
Ê╗éÇ╗¨▒¥Á──┐ÿ╦╩Ãú¼┬ô(li¿ón)║¤Ë├╦Äæ¬(y¿®ng)Èô▒╚▀B└m(x¿┤)¢o╦Ä©³Ëððºú¼Á½╩ÃðÞʬ┐╝æ]Á¢┬ô(li¿ón)║¤Ë├╦Ä═¿│ú▒╚å╬Ê╗»ƒÀ¿ò■îº(d¿úo)Í┬©³ÂÓÁ─©▒θË├íú
│╔╣ª░©└²
─I╝Ü░¹░®
pembrolizumab┬ô(li¿ón)║¤axitinib(VEGF╩▄¾w└Ê░▒╦ß╝ñ├©ÊÍÍãä®íó¦x╚)Í╬»ƒ─I╝Ü░¹░®ú¿KEYNOTE-426ú®
axitinib┼cavelumab(Bavencioú¼░ó¥S¶öå╬┐╣,¦x╚─¼┐╦ú®┬ô(li¿ón)║¤Ë├Ë┌Í╬»ƒ═Ýã┌─I╝Ü░¹░®ú¿JAVELIN Renal 101ú®
â╔ÀN┬ô(li¿ón)║¤Í╬»ƒÂ╝▒╚sunitinib©³Ëððºú¼▀@îº(d¿úo)Í┬┴╦▒O(ji¿ín)╣▄ÖCÿï(g¿░u)Á─┼·£╩íú
axitinib╩é▀▀xô±ðÈÁ─VEGFÊÍÍãä®ú¼½@Á├┴╦│╔╣ªíúÁ½╩ÃÁ═▀xô±ðÈÁ─sunitinibíó pazopanibú¼┬ô(li¿ón)Ë├ò■ʲã¥Ì┤¾Á─Â¥ðÈíú
║┌╔½╦Ï┴÷
È┌║┌╔½╦Ï┴÷Í╬»ƒÐð¥┐Íðú¼╚╦éâîªîóÊÐ┼·£╩Á─░ð¤‗╦Ä╬´╚þBRAFÊÍÍãä®dabrafenib║═MEKÊÍÍãä®trametinibú¼╗‗BRAFÊÍÍãä®vemurafenib║═MEKÊÍÍãä®cobimetinib┼c┐╣PD-1║═┐╣PD-L1Í╬»ƒ¤Ó¢Y(ji¿ª)║¤Ëð¤Ó«ö(d¿íng)┤¾Á─┼d╚ñíú
2020─Û6È┬ú¼IMspire150Èç‗×ê¾Á└ú¼┼cvemurafenib║═cobimetinib¤Ó▒╚ú¼vemurafenibíócobimetinib║═atezolizumab┬ô(li¿ón)║¤╩╣Ë├´@Í°ÐËÚL┴╦Íð╬╗PFSú¿15·1éÇÈ┬îª10·6éÇÈ┬)ú¼À┤æ¬(y¿®ng)│Í└m(x¿┤)òrÚgÈ÷╝Ë(21.0éÇÈ┬îª12·6éÇÈ┬ú®íú
▓╗│╔╣ªÁ─░©└²
ÍÁÁ├ÎóÊÔÁ─╩Ãú¼Ê╗Ýù3ã┌Ðð¥┐▒Ý├¸ú¼È┌BRAFÊ░╔·ð═─[┴÷Íðú¼cobimetinib║═atezolizumab┬ô(li¿ón)║¤╩╣Ë├▓ó▓╗â×(y¿¡u)Ë┌pembrolizumabú¿IMspire170ú®íú
┼cregorafenib¤Ó▒╚ú¼═¼ÿËÁ─┬ô(li¿ón)║¤Í╬»ƒÈ┌ÙyÍ╬ðÈÌD(zhu¿ún)ÊãðÈ¢Y(ji¿ª)Í▒─c░®╗╝ı▀ÍðÊ▓ø]Ëð´@╩¥│÷╚╬║╬ʵ╠Äú¿IMblaze370ú®íú
IDOÊÍÍãä®epacadostat ║═pembrolizumab┬ô(li¿ón)Ë├ú¼Î¯│§Á─ÀÃÙSÖCÈç‗×öÁ(sh¿┤)ô■(j¿┤)È┌»ƒðºÀ¢├µ║▄Ëð¤ú═¹ú¼ÃÊ┬ô(li¿ón)║¤Í╬»ƒø]Ëð├¸´@Á─È÷╝ËÂ¥ðÈíúÁ½╩Ã3ã┌pembrolizumab┼cepacadostat┬ô(li¿ón)║¤ú¿KEYNOTE-252ú®ú¼ø]Ëð╚╬║╬ʵ╠Ä║═¯~═ÔÁ─Â¥ðÈíú
├ÔÊ▀Öz▓Ú³cÊÍÍãä®ı²È┌┼cpoly(ADP-ribose) polymeraseÊÍÍãä®íóPI-3KÊÍÍãä®íóBTKÊÍÍãä®╝░©¸ÀNãõ╦¹░ð¤‗╦Ä╬´┬ô(li¿ón)║¤╩╣Ë├íú
½@Á├Á─¢ø(j¿®ng)‗×¢╠Ëû(x¿┤n)ú║
-
ÄÎ║§┐é╩ÃËð┐╔─▄┤_¿░▓╚½ÁÏ┬ô(li¿ón)║¤╩╣Ë├Á─╦Ä╬´Á─ä®┴┐
-
┐╝æ]Á¢Èþã┌ÀÃÙSÖCÐð¥┐Á─╗╝ı▀▀xô±ú¼ðÞʬÍö╔¸¢ÔßîüÝÎÈÈþã┌ÀÃÙSÖCÐð¥┐Á─»ƒðºöÁ(sh¿┤)ô■(j¿┤)
-
┬ô(li¿ón)║¤Ë├╦ÄÁ─┼R┤▓Ê▓╩ëÉ│úãDÙyÁ─ú¼╚╬║╬╠Ï¿¢M║¤Á─┼R┤▓Ã░öÁ(sh¿┤)ô■(j¿┤)Â╝æ¬(y¿®ng)Èô╩ÃÀÇ(w¿ºn)¢í┐╔┐┐Á─
3. ┬ô(li¿ón)║¤À┼»ƒ
│¼▀^100ÝùÈç‗×ı²È┌£yÈçÀ┼»ƒ╗‗À┼╔õ┼╝┬ô(li¿ón)╬´┼c├ÔÊ▀Í╬»ƒÁ─¢Y(ji¿ª)║¤íú
ÖCÍã
À┼╔õ▒╗ıJ×Ú═¿▀^ßîÀ┼─[┴÷┐╣È¡íóIð═©╔ö_╦ÏıTîº(d¿úo)║═©─Îâ├ÔÊ▀ÊÍÍã─[┴÷╬ó¡h(hu¿ón)¥│üÝ┤┘▀M├ÔÊ▀íú
ÙSÖC2ã┌Ðð¥┐PEMBRO-RT´@╩¥ú¼┴ó¾w¿¤‗¾wÀ┼»ƒ║¾╩╣Ë├Öz▓Ú³cÊÍÍãä®║¾ú¼îªıı¢M12Í▄Á─æ¬(y¿®ng)┤┬╩×Ú18%ú¼┬ô(li¿ón)║¤Öz▓Ú³cÊÍÍãä®12Í▄Á─æ¬(y¿®ng)┤┬╩×Ú36%(p=0·07)íúÙm╚╗ÈôÐð¥┐ø]Ëð▀_Á¢¯A(y¿┤)¤╚┤_¿Á─»ƒðº¢K³cú¼Á½╦³´@╩¥È┌PD-L1ÛÄðÈüå¢MÍðË^▓ýÁ¢ƒo▀Mı╣╔·┤µã┌║═┐é╔·┤µã┌½@ʵú¼▀@▒Ý├¸┴ó¾w¿¤‗╔ݾwÀ┼»ƒ┐╔─▄îªÍ╬»ƒ└õ─[┴÷Ëððºíú
4. ┬ô(li¿ón)║¤┴÷â╚(n¿¿i)Í╬»ƒ
╚▄┴÷▓íÂ¥
Talimogene laherparepvec╩ÃÊ╗ÀN©─┴╝Á─å╬╝â░Æı¯▓íÂ¥ú¼▒╗┼·£╩Ë├Ë┌▓╗┐╔Ãð│²Á─ãñ─wíóãñ¤┬║═┴▄░═¢Y(ji¿ª)║┌╔½╦Ï┴÷íú
Talimogene laherparepvec║═pembrolizumab┬ô(li¿ón)║¤Í╬»ƒ║┌╔½╦Ï┴÷òrú¼Ë^▓ýÁ¢©▀À┤æ¬(y¿®ng)┬╩ú¿62%ú®ú¼È┌▓┐ÀÍ╗╝ı▀Á─Îó╔õ▓íÎâ▓┐╬╗║═ÀÃÎó╔õ▓íÎâ▓┐╬╗Íðú¼Ë^▓ýÁ¢├ÔÊ▀╝Ü░¹¢■ØÖÈ÷╝Ëú¼PD-L1ÛûðÈ╝Ü░¹È÷╝Ëíú
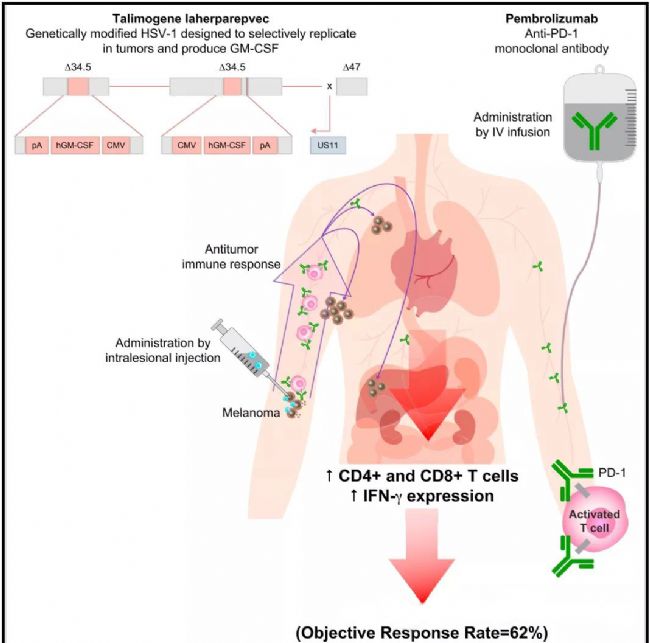
ãõ╦¹┴÷â╚(n¿¿i)θË├Á─╝ñäËä®
STING╝ñäËä®ú¼TollÿË╩▄¾w╝ñäËä®Á╚íú

5. ┬ô(li¿ón)║¤╝Ü░¹Í╬»ƒ
┼c╠ý╚╗T╝Ü░¹¯É╦ãú¼CAR-T╝Ü░¹Ê▓ò■▒Ý▀_PD-1║═ãõ╦¹ÊÍÍãÀÍÎËú¼´@╩¥║─¢▀╠Ïı¸íú
È┌┼R┤▓Ã░Ðð¥┐Íðú¼CAR-T╝Ü░¹┼cÖz▓Ú³cÊÍÍãä®Á─¢Y(ji¿ª)║¤ÊТø(j¿®ng)´@╩¥│÷┴╦¤ú═¹ú¼Á½╩Ã┼R┤▓Èç‗×▀ÇÈ┌Èþã┌íú
Ê╗ð®░©└²öÁ(sh¿┤)ô■(j¿┤)
░©└²Ê╗ú║È┌Ê╗ÝùÐð¥┐Íðú¼6└²B╝Ü░¹╝▒ðÈ┴▄░═╝Ü░¹░ÎЬ▓íÁ─â║┐ã╗╝ı▀Íðú¼Ëð3└²È┌CD19 CAR-T╝Ü░¹Í╬»ƒ║¾ú¼¢Ë╩▄pembrolizumabÍ╬»ƒú¼▒ݼF(xi¿ñn)│÷┼R┤▓À┤æ¬(y¿®ng)║═CAR-T╝Ü░¹Á─│Í└m(x¿┤)┤µÈ┌ú¼ÃÊ╝Ü░¹Ê‗ÎËßîÀ┼¥C║¤ı¸ø]ËðÉ║╗»íú
░©└²Â■ú║È┌┴ÝÊ╗ÝùÐð¥┐Íðú¼1└²È¡░l(f¿í)ðÈ┐v©¶┤¾B╝Ü░¹┴▄░═┴÷╗╝ı▀È┌pembrolizumabÍ╬»ƒ║¾îªCD19 CAR-T╝Ü░¹╗ÍÅ═(f¿┤)À┤æ¬(y¿®ng)íú
░©└²╚²ú║È┌┴ÝÊ╗ÝùÈç‗×Íðú¼12└²B╝Ü░¹ÀÃ╗¶ãµ¢┴▄░═┴÷╗╝ı▀ú¼È┌CD19 CAR-T╝Ü░¹Í╬»ƒ║¾▓íÃÚ▀Mı╣ú¿n=8)╗‗Å═(f¿┤)░l(f¿í)(n=4ú®¢Ë╩▄╣╠¿ä®┴┐Á─pembrolizumab(├┐3Í▄ýo├}Îó╔õ200mgú¼Í▒Á¢▀Mı╣ú®ú¼ORR×Ú27%ú¼ê¾©µËðÊ╗éÇ═Û╚½¥Å¢Ôíú
░©└²╦─ú║5└²BCMA CAR-T╝Ü░¹╩ºöíÁ─ÂÓ░l(f¿í)ðÈ╣Ã╦Þ┴÷╗╝ı▀¢Ë╩▄pembrolizumabÍ╬»ƒú¼2└²╗╝ı▀Ëð▓┐ÀÍÀ┤æ¬(y¿®ng)ú¼ãõÍð1└²┼cCAR-T╝Ü░¹öUÈ÷¤ÓÛP(gu¿ín)ú¿╬─½I4ú®íú
└¹Ë├¢Y(ji¿ª)║¤CAR-T╝Ü░¹║═Öz▓Ú³cÊÍÍãä®Á─┼R┤▓Èç‗×?z¿íi)┐Ã░▀ÇËð║▄ÂÓı²È┌▀MððÍð(NCT02706405, NCT03310619, NCT02926833, NCT03287817, NCT02650999)íú
6. ┬ô(li¿ón)║¤─[┴÷Ê▀├þ
Ê▀├þ┼c├ÔÊ▀Öz▓Ú³cÊÍÍã䮢Y(ji¿ª)║¤┐╔È÷Åè├ÔÊ▀È¡ðÈú¼È÷Åè├ÔÊ▀À┤æ¬(y¿®ng)ú¼┐╦À■├ÔÊ▀ÊÍÍã─[┴÷╬ó¡h(hu¿ón)¥│ú¼È÷╝Ë─[┴÷╠Ï«ÉðÈT╝Ü░¹íúÊ‗┤╦ú¼Ê▀├þı²È┌┼cÖz▓Ú³cÊÍÍãä®║═░ð¤‗ı{(di¿ño)╣Ø(ji¿ª)ðÈ├ÔÊ▀╝Ü░¹║═ãõ╦¹─[┴÷╬ó¡h(hu¿ón)¥│ı{(di¿ño)╣Ø(ji¿ª)ä®Á─▓▀┬È¢Y(ji¿ª)║¤Ú_░l(f¿í)íú
NCT03948763ú¼A Study of mRNA-5671/V941 as Monotherapy and in Combination With Pembrolizumab (V941-001)
░®░YÊ▀├þÐË╔ýÚåÎxú║Í╬»ƒðÈ░®░YÊ▀├þ
7. ┬ô(li¿ón)║¤Ùp╠Ï«ÉðÈ┐╣¾w
T╝Ü░¹ıð─╝Ùp┐╣ú¿TCBú®ı╝ô■(j¿┤)┴╦50%Á─Ùp┐╣╣▄¥Çú¼Á½╩Ã╚þ╣¹T╝Ü░¹▒¥╔Ý╩Ã║─¢▀á¯æB(t¿ñi)ú¼ät▓óƒoÀ¿ãÁ¢Üóé¹─[┴÷Á─╗¯ðÈú¼Ê‗°┬ô(li¿ón)║¤PD-1┐╣¾wú¼╗ÍÅ═(f¿┤)T╝Ü░¹╗¯ðÈú¼└Ýıô╔¤┐╔ÊÈÈ÷Åè┐╣─[┴÷╗¯ðÈíú°TCBät┐╔ÊÈÈ÷╝ËT╝Ü░¹¤‗─[┴÷Á─ÍÏ¿¤‗ú¼┐╦À■└õ─[┴÷îªPD-1┐╣¾w▓╗├¶©ðÁ─åû¯}íú─[┴÷├ÔÊ▀╚²ÀÍð═┼c├ÔÊ▀Öz▓Ú³cÊÍÍãä®Í╬»ƒ

8. ┬ô(li¿ón)Ë├ãõ╦¹Öz▓Ú³cÊÍÍãä®
PD-1─═╦ÄÁ─Ê╗éÇÍÏʬÖCÍã╩Ãú║ãõ╦¹├ÔÊ▀Öz▓Ú³cÁ─╔¤ı{(di¿ño)íúCancer Cellú║╬ÕéÇ├ÔÊ▀Öz▓Ú³cÊÍÍã䮽@Á├ðÈ─═╦ÄÖCÍã
Ê‗°┬ô(li¿ón)Ë├ãõ╦¹├ÔÊ▀Öz▓Ú³cÊÍÍãä®ú¼╩ÃÊ╗éÇÍÏʬ▓▀┬Èíú▒╚╚þ¢ø(j¿®ng)ÁõÁ─CTLA-4║═PD-1┬ô(li¿ón)Ë├íúú¿Ê‗×Ú▀^©▀Â¥ðÈú¼Ùp╠Ï«ÉðÈ┐╣¾w╩üF(xi¿ñn)È┌Á─Ú_░l(f¿í)À¢¤‗íúú®

9 ┬ô(li¿ón)║¤╝Ü░¹Ê‗ÎË
IL-2║═IL-15╩Ã├ÔÊ▀Í╬»ƒÁ─ÍÏʬ╩ÍÂ╬ú¼àó┐╝ÚåÎx
ÍÁÁ├ÛP(gu¿ín)ÎóÁ──[┴÷├ÔÊ▀Í╬»ƒÀÍÎËú║IL-15╝░¤ÓÛP(gu¿ín)╦Ä╬´ú¿║Ò╚ßt(y¿®)╦Äíó▓®ÙH╔·╬´╦Ä╬´▀M╚Ù┼R┤▓ú®
╝Ü░¹Ê‗ÎË╦Ä╬´╣ñ│╠©─Èý
¼F(xi¿ñn)È┌Ú_╩╝║═PD-1┐╣¾w▀Mðð┬ô(li¿ón)║¤Í╬»ƒ┼R┤▓Ðð¥┐
IL-2ú¿ NCT03835533ú¼NCT03138889ú®íóIL-15ú¿NCT02452268ú║A Phase I/Ib Study of NIZ985 in Combination With PDR001 in Adults With Metastatic Cancersú®íú
║åÈuú║PD-1╦Ò╩Ã─[┴÷Í╬»ƒ░┘─ÛÙyË÷Á─╔±╦Äú¼║¾PD-1òr┤·ú¼╗¨Ë┌PD-1/PD-L1Á─┬ô(li¿ón)║¤Í╬»ƒ╩Ã╦Ä╬´Ú_░l(f¿í)╝░┼R┤▓╩╣Ë├Á─ÍϳcíúÁ½┬ô(li¿ón)║¤Í╬»ƒÁ─Ê╗éÇ͸ʬåû¯}ú║Â¥ðÈ...
͸ʬàó┐╝╬─½I
-
Schmid P, Adams S, Rugo HS, et al. Atezolizumab and nab-paclitaxel in advanced triple-negative breast cancer. N Engl J Med 2018; 379: 2108–21.
-
Theelen WSME, Peulen HMU, Lalezari F, et al. Effect of pembrolizumab after stereotactic body radiotherapy vs pembrolizumab alone on tumour response in patients with advanced non-small cell lung cancer: results of the PEMBRO-RT phase 2 randomised clinical trial. JAMA Oncol 2019; 5: 1276.
-
Ribas A, Dummer R, Puzanov I, et al. Oncolytic virotherapy promotes intratumoural t cell infiltration and improves anti-PD-1 immunotherapy. Cell 2017; 170: 1109–19
-
Bernabei L, Garfall AL, Melenhorst JJ, et al. PD-1 Inhibitor combinations as salvage therapy for relapsed/refractory multiple myeloma (MM) patients progressing after bcma-directed CAR T cells. Blood 2018; 132 (suppl 1): 1973.
-
Meric-Bernstam F, et al. Enhancing anti-tumour efficacy with immunotherapy combinations.Lancet. 2021 Mar 13;397(10278):1010-1022
-
Kobold S, Pantelyushin S, Rataj F, Vom Berg J. Rationale for combining bispecific T cell activating antibodies with checkpoint blockade for cancer therapy. Front Oncol 2018; 8: 285.
- ╬─½I¢Ô╬÷ú║©▀╔¯Â╚├ÔÊ▀Ù─¢MîW(xu¿ª)‗î(q¿▒)äËÊ╚¤┘░®Ù[├Ï┐╣È¡═┌¥‗
- Elispotú¿├©┬ô(li¿ón)├ÔÊ▀░▀³cÖz£yú®ÿË▒¥Íãéõ¢Ú¢B
- ░┘¦Þ╔·╬´╚½├µ¢Ô┤aÏi├ÔÊ▀Ù─¢MÐð¥┐ú¼┘x─▄Ê▀├þÚ_░l(f¿í)║═╬┴▓íÀ└┐Ï
- ı{(di¿ño)┐ÏRNAÁ─θË├ÖCÍã╝░æ¬(y¿®ng)Ë├
- ├ÔÊ▀Ù─¢MîW(xu¿ª)Í·┴ª¢Y(ji¿ª)Í▒─c░®ð┬╔·┐╣È¡┼c╝Ü¥·┐╣È¡Á─░l(f¿í)¼F(xi¿ñn)
- å╬ÀÍÎËÛç┴ðSimoa╝╝ðg(sh¿┤)Í·┴ª─X-¾w▀B¢ËÐð¥┐
- H5N1æ┴¸©ð▓íÂ¥©ð╚¥´L(f¿Ñng)ÙU┼cÈþã┌Öz£yÀ¢À¿
- CDR3╣ñ│╠┼cÍð║═┐╣¾w¿Íãú║▒úÎCð═┐╣¾wÍÏ╦▄Í╬»ƒð┬ÿ╦£╩
- ÐðËæò■ú║AI‗î(q¿▒)äË┘|(zh¿¼)ÎV╝╝ðg(sh¿┤)┘x─▄╔·╬´╦ÄÐð░l(f¿í)┼c├ÔÊ▀Í╬»ƒ
- ░┘èW┘ÉêDй─·¤Ó╝sChinaBio║¤Î¸ıôë»
- ░┘èW┘ÉêD┼cMyricx▀_│╔┐╣¾wÈu╣└àf(xi¿ª)ÎhË┌ADC╦Ä╬´Ú_░l(f¿í)
- 2023─Û░┘¦Þ╔·╬´┐ã╝╝ı\ã©ÂÓéÇìÅ╬╗
- Îú┘R░┘¦Þ╔·╬´╔¤║úÐð░l(f¿í)Íðð─å╠▀wð┬ÍÀ┼cð┬╣┘¥W(w¿úng)╔¤¥Ç
- Ø·À▓╔·╬´┴┴¤ÓIND©ð╚¥ðÈ╝▓▓í¤╚▀MÀÍÎËÈ\öÓæ¬(y¿®ng)Ë├ıôë»
- Áv║═ßt(y¿®)╦Ä┐╣¾wÈ┌╚½Ã‗Iã┌┼R┤▓Ðð¥┐═Û│╔╩Î└²╗╝ı▀¢o╦Ä
- ░┘èW┘ÉêD┼c─¤¥®ı²┤¾╠ýÃþ║×╩╚½╚╦┐╣¾w║¤Î¸Ú_░l(f¿í)àf(xi¿ª)Îh