恒河猴感染COVID-19的分子機制及潛在治療藥物
臨床組織是分子機制研究的首選樣本,但COVID-19臨床組織很少,且大多來自終末期患者的尸檢。動物模型,尤其是非人靈長類動物模型的建立,可為COVID-19相關研究奠定基礎。
2022年1月北京協和醫學院楊俊濤教授在Signal transduction and targeted therapy(IF 18.187)雜志上發表題目為“Proteomic and phosphoproteomic profiling of COVID-19-associated lung and liver injury: a report based on rhesus macaques”的研究成果,利用蛋白組學和磷酸化蛋白組學首次對感染SARS-CoV-2的恒河猴早期肺組織和肝組織分子變化進行研究,為進一步研究SARS-CoV-2的分子機制和藥物發現提供了有效的數據資源。

研究材料:
空白對照組和病毒感染組;SARS-CoV-2感染7天后的恒河猴肺、肝組織(n=8)
技術路線:
步驟1:肺、肝損傷表型分析
步驟2:蛋白組學分析
步驟3:差異蛋白PPI互作
步驟4:磷酸化蛋白組學分析
步驟5:激酶預測
步驟6:激酶與藥物整合預測
研究結果:
1. 恒河猴SARS-CoV-2感染后肺、肝損傷檢測
采用定量RT-PCR方法檢測感染恒河猴鼻、喉、肛門拭子中SARS-CoV-2 RNA含量,確定7天后SARS-CoV-2 病毒含量趨于穩定(圖1a)。從胸片可直觀看到,病毒感染組恒河猴肺部間質濾過和滲出性病變(圖1b)。與對照組相比,感染組恒河猴肺部有多個病理病變和出血點(圖1c)。進一步定量RT-PCR檢測發現,感染組恒河猴肝臟中的病毒載量低于肺部(圖1d)。從病理切片可以看到感染組恒河猴肺部有明顯的炎性細胞浸潤,肺間隔局部增厚,血管血栓形成;肝臟中肝竇間隙增寬、炎癥細胞散在浸潤(圖1e)。
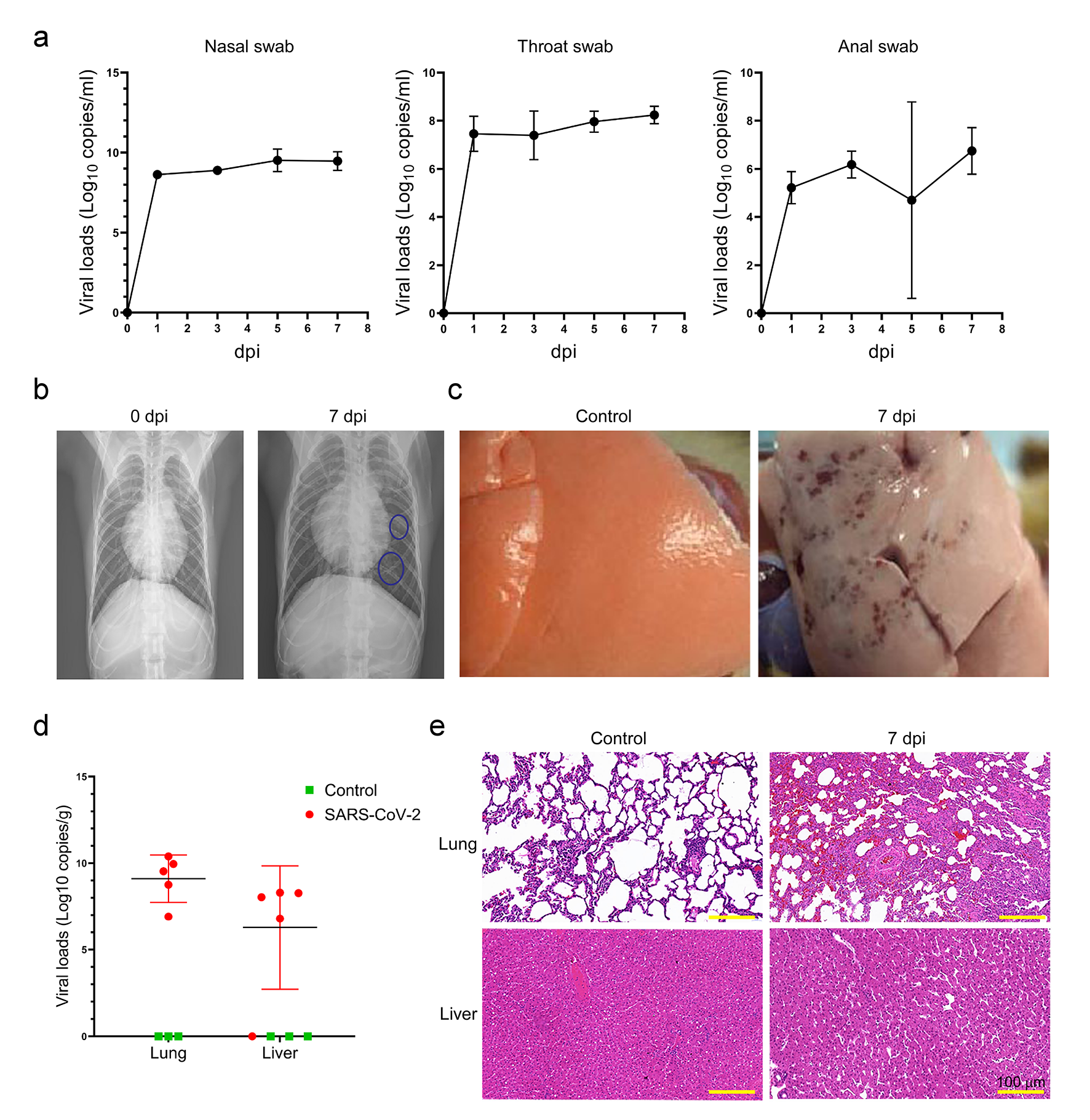
圖1 恒河猴SARS-CoV-2感染及隨后肺、肝損傷的驗證
2.恒河猴SARS-CoV-2感染后肺、肝組織蛋白組學分析
蛋白質組學定量了肺中6715個蛋白和肝臟中5238個蛋白。主成分分析(PCA)結果顯示,對照組和病毒感染組之間肝臟蛋白表達譜的總體差異大于肺(圖2b,c)。與對照組相比,感染組肺組織和肝組織差異表達蛋白分別為757個和1219個(圖2d)。KEGG通路富集分析顯示,在感染組的肺組織中,核糖體、DNA復制、RIG- I樣受體或信號通路、錯配修復等相關通路蛋白上調;與ECM -受體相互作用關系最為密切蛋白的下調(圖2e)。在感染組的肝臟組織中,核糖體、氨基酰基-tRNA生物合成、氧化磷酸化等相關通路蛋白上調;剪接體、調控肌動蛋白細胞骨架和局部粘附等相關蛋白下調(圖2f)。

圖2 恒河猴SARS-CoV-2感染后肺、肝組織蛋白比較
3.差異蛋白PPI互作分析
將通路富集到的蛋白進行蛋白相互作用(PPI)分析。肺部(圖3a)和肝臟(圖3b)在感染后均出現代謝相關蛋白和核糖體相關蛋白水平升高。結合KEGG和STRING數據庫,發現感染組肺組織RIG-I通路、蛋白加工、DNA復制和修復相關蛋白上調,肝組織氧化呼吸鏈和蛋白質加工通路相關蛋白發生顯著變化。蛋白酶介導的蛋白質降解在肺中活躍,但在肝臟中受到抑制(圖3c,d)。同時發現,SARS-CoV-2感染7天后,局灶性粘連周圍蛋白呈下降趨勢。整合素α家族中的ITGA5和鏈接ECM和細胞骨架的DAG1在感染肺和肝臟組織中均下降(圖3c,d)。

圖3 差異蛋白互作分析
4. 恒河猴SARS-CoV-2感染后肺、肝組織磷酸化蛋白組學分析
磷酸化是細胞對刺激做出反應的一種快速調節方法,已在一些SARS-CoV-2感染的細胞模型或尸檢樣本中檢測到。因此,作者分析了恒河猴肺和肝臟的磷酸化蛋白質組,以期找到SARS-CoV-2感染期間的潛在藥物靶點。共定量了肺中4185個蛋白質的12,418個磷酸位點和肝臟中3191個蛋白質的8134個磷酸化位點。其中,肺部873個蛋白質的1162個位點和肝臟712個蛋白質中的960個位點差異表達。通路富集和PPI互作分析發現,肺中上調的磷酸化蛋白富集于代謝、剪接體和泛素介導的蛋白水解等途徑,而下調磷酸化蛋白與Fc-γ-R介導的吞噬、粘附連接和基礎轉錄因子相關(圖4a)。在肝臟中,上調的磷酸化蛋白富集于多種代謝途徑,而下調的磷酸化蛋白與基礎轉錄因子、剪接體、RNA轉運等相關(圖4b)。PPI互作結果顯示,上調的磷酸化蛋白多于下調的磷酸化蛋白(圖4c,d)。
磷酸化是細胞對刺激做出反應的一種快速調節方法,已在一些SARS-CoV-2感染的細胞模型或尸檢樣本中檢測到。因此,作者分析了恒河猴肺和肝臟的磷酸化蛋白質組,以期找到SARS-CoV-2感染期間的潛在藥物靶點。共定量了肺中4185個蛋白質的12,418個磷酸位點和肝臟中3191個蛋白質的8134個磷酸化位點。其中,肺部873個蛋白質的1162個位點和肝臟712個蛋白質中的960個位點差異表達。通路富集和PPI互作分析發現,肺中上調的磷酸化蛋白富集于代謝、剪接體和泛素介導的蛋白水解等途徑,而下調磷酸化蛋白與Fc-γ-R介導的吞噬、粘附連接和基礎轉錄因子相關(圖4a)。在肝臟中,上調的磷酸化蛋白富集于多種代謝途徑,而下調的磷酸化蛋白與基礎轉錄因子、剪接體、RNA轉運等相關(圖4b)。PPI互作結果顯示,上調的磷酸化蛋白多于下調的磷酸化蛋白(圖4c,d)。

圖4 恒河猴肺、肝中差異磷酸化蛋白KEGG通路富集和PPI分析
5. 恒河猴SARS-CoV-2感染后肺、肝組織激酶預測
為獲得更多信息,將恒河猴肺和肝組織磷酸化位點進行激酶預測。在肺中,與炎癥(PKR、IKKβ、P38δ和JNK3)、細胞周期(CDK1和CDK2)、增殖(MAP2K1和MAP2K2)和代謝(AKT3、PKCi和AMPKs)相關的激酶被激活,而細胞骨架重組相關激酶MRCKα被抑制(圖5a)。在肝臟中,代謝相關的激酶(AMPKs和PKCs)被激活,而炎癥相關的激酶(JNK1和JNK2)則處于靜止甚至抑制狀態(圖5b)。在蛋白組和磷酸化蛋白組數據中并沒有發現所有的預測激酶(圖5c,d),說明激酶預測分析能擴大SARS-CoV-2作用靶點的探索范圍。

圖5 恒河猴肺和肝中的激酶分析
6. 恒河猴SARS-CoV-2感染后肺、肝組織激酶與藥物整合分析
將DrugBank數據庫中的藥物與激酶預測結果進行整合分析, 發現11種FDA批準的藥物可能對預測的激酶有效,其中福坦替尼(Fostamatinib)、米諾環素(minocycline)和他莫西芬(tamoxifen)在肺和肝臟中可能都起作用(圖6)。

圖6 藥物與恒河猴肺和肝中的激酶桑基圖
小結:
與人類的尸檢樣本相比,恒河猴模型能夠提供一個在感染早期研究組織分子變化的機會。研究人員首次對恒河猴SARS-CoV-2感染的肺和肝組織進行了蛋白質組學和磷酸化蛋白質組學分析,發現在受感染的肺和肝臟中,蛋白質合成和加工均激活,ECM、細胞間連接和細胞骨架均失調,但肺和肝臟都沒有纖維化。并且發現,肺部在感染期間炎癥反應增強,而肝臟在感染期間氧化磷酸化和代謝過程增強。該研究為進一步探索SARS-CoV-2的機制和藥物發現提供了有效的數據來源。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com